„Schmerz lass nach!“
RUB-Forscher entschlüsseln Zusammenspiel von Enkephalinen und Schmerzrezeptoren
„Schmerz lass nach!“ Um dieses Signal zu senden, produziert der menschliche Körper kleine Botenstoffmoleküle, die an bestimmte Rezeptoren andocken. Dieses Zusammenspiel zwischen den Botenstoffen, Enkephaline genannt, und Opioidrezeptoren ist mit herkömmlichen biochemischen Methoden schwer zu untersuchen. Einem interdisziplinären Team von Biochemikern und Anorganischen Chemikern der Ruhr-Universität Bochum (RUB) gelang es nun, die Struktur eines Enkephalins in Lösung zu bestimmen und erstmals seine Interaktion mit dem Opioidrezeptor im Detail zu verfolgen. Die Analyse liefert präzise neue Ansatzpunkte für die Entwicklung von Medikamenten, die gezielt bestimmte Arten von Schmerz bekämpfen.
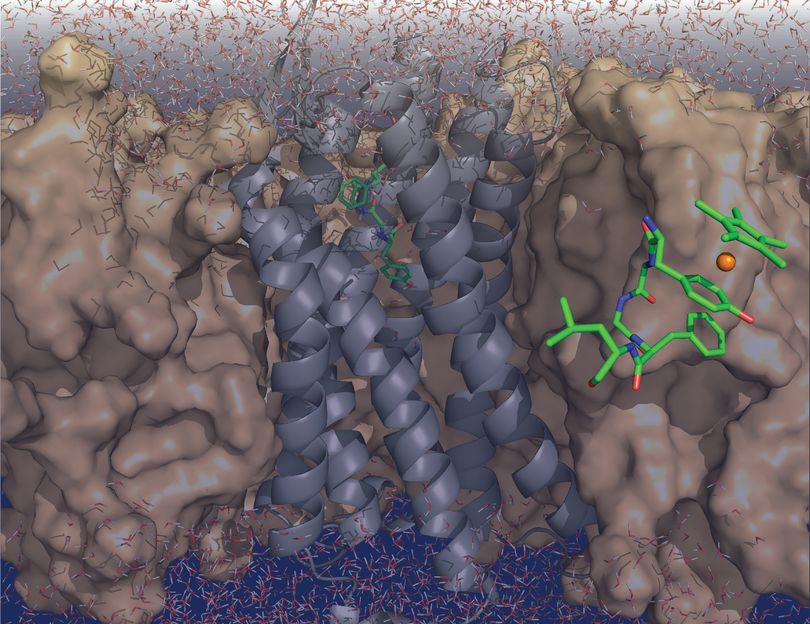
Der Enkephalin-Rezeptor (grau) durchspannt die Zellmembran. In Grün ist die Struktur des freien Enkephalins im Komplex mit dem Rhodiumatom (orange) gezeigt.
© Florian Wieberneit (AG Biomolekulare NMR)
Rhodium erlaubt Analyse von Enkephalinen in Lösung
Enkephalin ist ein Peptid; es besteht aus Aminosäuren. In Lösung ist es sehr flexibel, sodass Forscher das kleine Molekül nur schwer für Strukturanalysen „zu fassen“ bekommen. Die RUB-Chemiker nutzten einen Trick: In das Enkephalin brachten sie einen Komplex ein, der das Edelmetall Rhodium enthielt und in der Natur nicht vorkommt. Die Struktur des Metall-Peptid-Komplexes untersuchten sie dann mit kernmagnetischer Resonananzspektroskopie, kurz NMR (nuclear magnetic resonance). Mit gebundenem Rhodium ließ sich das Enkephalin wesentlich umfassender beobachten als zuvor. In Computersimulationen berechneten die Forscher dann, wie sich die mit NMR bestimmte Struktur des Enkephalins optimal in die bekannte dreidimensionale Struktur des Rezeptors einpassen lässt.
Rund 40 Jahre nach der Entdeckung
Die Enkephaline wurden als erste Neuropeptide überhaupt bereits in den 70er-Jahren entdeckt und intensiv erforscht. Die zugehörigen Opioidrezeptoren, die zur Klasse der sogenannten G-Protein-gekoppelten Rezeptoren gehören, entzogen sich jedoch jahrzehntelang der Strukturanalyse. Erst im vergangenen Jahr wurden einige ihrer Strukturen aufgeklärt, und der Chemie-Nobelpreis 2012 für die Erforschung der G-Protein-gekoppelten Rezeptoren brachte neuen Schwung in das Arbeitsgebiet. „Jetzt plötzlich – etwa 40 Jahre nach der Entdeckung der Enkephaline – können wir auf atomarer Ebene verstehen, wie diese Botenstoffe an ihre Rezeptoren binden“, sagt Prof. Dr. Nils Metzler-Nolte, der die RUB-Arbeitsgruppe Medizinische Anorganische Chemie leitet. „Unsere Arbeit zeigt, wie der gezielte Einsatz von in der Natur nicht vorkommenden Metallkomplexen durchaus einen Beitrag liefern kann, seit langem offene Fragen in der Medizin zu klären“, ergänzt Prof. Dr. Raphael Stoll von der AG Biomolekulare Spektroskopie.
Originalveröffentlichung

Holen Sie sich die Chemie-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.