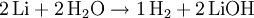Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Mol
Das Mol (Einheitenzeichen: mol) ist die SI-Basiseinheit der Stoffmenge. Wichtig ist das Mol für Mengenangaben bei chemischen Reaktionen. Weiteres empfehlenswertes Fachwissen
DefinitionEin Mol ist die Stoffmenge eines Systems, das aus ebensoviel Einzelteilchen (Atome, Moleküle, Ionen, Elektronen, Äquivalentteilchen, ...) besteht, wie Atome in 12 Gramm des Kohlenstoff-Nuklids 12C enthalten sind; ob diese mit „ebensoviel wie“ beschriebene Teilchenzahl ganzzahlig ist, ist derzeit unbekannt. Bei Verwendung des Mol müssen die Teilchen genau spezifiziert sein. Im SI ist das Mol eine Basiseinheit. Teilchenzahl und Stoffmenge sind einander proportional, so dass eine beliebige dieser beiden Größen als Maß für die andere dienen kann. Die Teilchenzahl pro Stoffmenge (Avogadro-Konstante) beträgt: Ein Mol eines Stoffes enthält also ca. 602 Trilliarden Teilchen dieses Stoffes. Folgende Zahlenwerte sind identisch: Der Zahlenwert der Masse eines Teilchens in der atomaren Masseneinheit u − den nannte man in der Chemie früher relative Atommasse oder „Atomgewicht“ – und der Zahlenwert der Masse von einem Mol dieses Teilchens in Gramm (siehe Beispiel dazu unten: Molare Masse). HistorischesIm SI ist 1971 das Mol als Basiseinheit eingeführt worden. Damit wurde der Anwendungsbereich des SI auf die Chemie ausgedehnt. Vor Etablierung des SI ist das Mol überwiegend als Masseneinheit angesehen worden. So heißt es in DIN 1310 „Gehalt von Lösungen“ vom April 1927: „Als Masseneinheiten dienen ... das Mol, d. h. soviel Gramm des Stoffes, wie sein Molekulargewicht angibt...“. Allerdings wurde durch die Anwendung des Molekular„gewichts“ hier eine Stoffmasse, keine -menge heutiger Sicht, beschrieben und als „Stoffmenge“ bezeichnet. In der heutigen Mol-Definition des SI hingegen wird die Stoffmenge von Teilchenzahl und Masse formal klar unterschieden. Molares VolumenDas molare Volumen eines Stoffes ist eine stoffspezifische Eigenschaft, die angibt, welches Volumen ein Mol eines Stoffes ausfüllt. Für ideale Gase gilt, dass ein Mol bei Normalbedingungen (273,15 K, 101325 Pa) ein Volumen von 22,414 Litern einnimmt. Für reale Gase, Feststoffe und Flüssigkeiten ist das molare Volumen hingegen stoffabhängig. Molare MasseDie molare Masse M ist der Quotient aus Masse und Stoffmenge eines Stoffes. In der Einheit g/mol besitzt sie denselben Zahlenwert wie die Atommasse, also die Masse eines Atomes, in u (atomare Masseneinheit). Ihre Bedeutung ist äquivalent zum früheren „Atomgewicht“ in der Chemie. Berechnung von StoffmengenZur Berechnung wird folgende Formel verwendet:
Dabei bezeichnet n die Stoffmenge, m die Masse und M die molare Masse. M kann für chemische Elemente Tabellenwerken entnommen und für chemische Verbindungen bekannter Zusammensetzung aus solchen Werten errechnet werden. (Es ist nicht zu verwechseln mit der teilweise verwendeten (Nicht-SI-) Einheit für die Konzentration Die atomare Masse, die für jedes chemische Element in Tabellen angegeben wird, bezieht sich dabei auf das natürliche Isotopengemisch. So ist zum Beispiel als Atommasse für Kohlenstoff 12,011 u angegeben. Dieser Wert ist zum Beispiel für in 13C angereichertes Material nicht anzuwenden. Während bei stabilen Elementen die Abweichungen von Isotopenmischungen, wie sie in der Natur vorkommen, relativ gering sind, kann insbesondere bei radioaktiven Elementen das Isotopengemisch stark von der Herkunft und dem Alter des Materials abhängen. Verwendung der Einheit Mol bei KonzentrationsangabenDie Einheit Mol findet häufig Verwendung in zusammengesetzten Einheiten zur Angabe von Konzentrationen (Lösungen, Säuregehalt von Lösungen usw.). Eine der häufigsten Verwendungen ist die x-molare Lösung (das x steht darin für eine beliebige rationale positive Zahl). Die Bedeutung ist
MolschrumpfungDie Molschrumpfung bezeichnet eine Reduzierung des Gasvolumens, die in einem Gasgemisch nach der Reaktion der Edukte eintritt, wie z. B. in einem stöchiometrischen Wasserstoff-Sauerstoffgemisch (Knallgas), bei dem der Wasserstoff mit dem Sauerstoff reagiert, wonach sich das Volumen auf ein 1800stel reduziert (vgl. Wasserstoffverbrennungsmotor). Sie steht im Gegensatz zur Molspaltung, der Vervielfachung der Teilchenzahl bei vielen Verbrennungsprozessen wie in diesel- oder benzin-betriebenen Motoren. Beide Prozesse machen einen Gasaustausch erforderlich. Beispiele
Herstellung von Lithiumhydroxid Bei der Bildung von LiOH werden also pro zwei Lithiumatomen zwei Wassermoleküle verbraucht. Weil in jedem Mol von jeder Substanz gleich viele Teilchen vorhanden sind (siehe oben), braucht man 2 mol Lithium und 2 mol Wasser oder eine beliebige andere Stoffmenge im 2:2-Verhältnis.
Anwendungsbeispiel
Präfixe
Literatur
Siehe auch
Kategorien: Chemische Größe | SI-Einheit |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Mol aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||





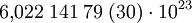
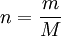
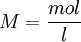 )
)