Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Reguläre LösungstheorieDie Reguläre Lösungstheorie[1][2] beschreibt ein Verfahren zur Abschätzung von Aktivitätskoeffizienten (γ) in Mischungen, deren Verhalten nur wenig vom Raoultschen Gesetz abweicht. Solche Lösungen werden in diesem Modell als regulär bezeichnet. Weiteres empfehlenswertes FachwissenBestimmungsgleichungenFür ein binäres Gemisch gilt
mit Aktivitätskoeffizienten Volumina der reinen Flüssigkeiten Volumenbrüche Löslichkeitsparameter
ZusammenfassungMit der regulären Lösungstheorie lassen sich die Aktivitätskoeffizienten der Komponenten eines Gemischs alleine aus den leicht zugänglichen Reinstoffeigenschaften Verdampfungsenthalpie und Flüssigvolumen bestimmen. Zu beachten ist aber, dass etliche Vereinfachungen und Annahmen die Qualität der Vorhersage stark begrenzen. Literatur |
| Dieser Artikel basiert auf dem Artikel Reguläre_Lösungstheorie aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





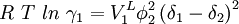
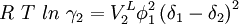
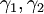
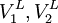
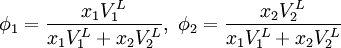
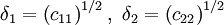
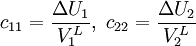
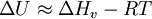
 Temperatur
Temperatur