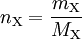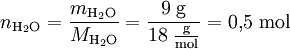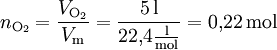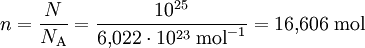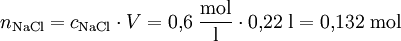Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Stoffmenge
Mit Stoffmenge wird die quantitative Mengenangabe für Stoffe, besonders in der Chemie, bezeichnet. Diese Stoffmenge ist dabei weder Masse, noch Teilchenzahl, sondern im Internationalen Einheitensystem (SI) durch willkürliche Vereinbarung als Basisgröße eigener Art festgelegt. Das bedeutet, sie ist auch nicht durch andere SI-Basisgrößen darstellbar. Die Einheit der Stoffmenge ist das Mol, eine SI-Basiseinheit. Weiteres empfehlenswertes FachwissenBei Verwendung des Mols muss die zugrunde gelegte Anzahl der Teilchen (insbesondere Atome und Moleküle) genau festgelegt werden; ein Mol eines Stoffes enthält etwa 6,02214179(30)·1023 [1] solcher Teilchen (Avogadro-Zahl NA, auch Loschmidt-Zahl). Diese Teilchen können auch gedachte Bruchstücke realer Teilchen (z. B. 1/4 eines Moleküls oder Ions) – so genannte Äquivalentteilchen oder kurz Äquivalente – sein, so dass die veraltete Einheit Val für Äquivalentgewichte ohne Änderungen an vertrauten Zahlenwerten durch das Mol ersetzt werden kann. Viele Einzelheiten hierzu stehen in der deutschen Norm DIN 32 625. Für die Stoffmenge nX und die Masse mX einer Stoffportion eines Reinstoffes X und dessen molare Masse MX gilt folgender Zusammenhang: Berechnung der StoffmengeDie Berechnung der Stoffmenge erfolgt
Die Berechnung aus der Masse ist über die oben angegebene Gleichung möglich. Beispiel: Die molare Masse von Wasser beträgt 18 Gramm pro Mol. 9 Gramm Wasser entsprechen damit einer Stoffmenge von 0,5 Mol.
Bei Gasen lässt sich verhältnismäßig leicht die Stoffmenge aus dem Volumen bestimmen, da ein Mol eines beliebigen Gases bei Normalbedingungen in Näherung ein Volumen von 22,4 Litern einnimmt. Dieses Volumen bezeichnet man als molares Normvolumen (Molvolumen): Vm = 22,4 l/mol. Beispiel: Wieviel Mol entsprechen 5 l Sauerstoff-Molekülen O2?
Da ein Mol einer Teilchenanzahl von ca. 6,022 · 1023 (Avogadrozahl NA) entspricht, kann man aus der Anzahl der Teilchen die Stoffmenge berechnen. Beispiel: Gegeben sind N = 1025 Teilchen.
Da die Molarität cX (mol/l) ein Konzentrationsmaß für Lösungen darstellt, das die Stoffmenge eines Stoffes X in Beziehung zum Volumen V der Lösung stellt, kann man diese auch auf die Stoffmenge zurückrechnen. Beispiel: Wieviel Mol Natriumchlorid befinden sich in 0,22 Liter einer 0,6 molaren NaCl-Lösung? Quelle
Siehe auch
Kategorien: Chemische Größe | Physikalische Chemie |
||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Stoffmenge aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||