Der Schnellere gewinnt
Enantioselektive Synthese von Indol-Derivaten
Anzeigen
Indol und davon abgeleitete Strukturen sind ein Grundbestandteil vieler Naturstoffe wie der Aminosäure Tryptophan. Eine neue katalytische Reaktion liefert Cyclopenta[b]indole – Gerüste aus drei kantenverbundenen Ringen – sehr selektiv in der gewünschten räumlichen Struktur. Wie ein Forschungsteam in der Zeitschrift Angewandte Chemie berichtet, spielt dabei die Geschwindigkeit der Reaktionsschritte eine entscheidende Rolle.
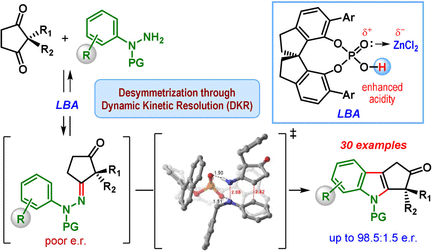
© Wiley-VCH
Indol-Derivate sind in der Natur weit verbreitet, etwa als Teil von Serotonin und Melatonin sowie vieler Alkaloide, von denen einige als Pharmaka, z.B. zur Behandlung der Parkinson-Krankheit, eingesetzt werden. Indol besteht aus einem aromatischen Sechsring und einem Fünfring, die über eine Kante verbunden sind. Der Fünfring enthält eine Doppelbindung und ein Stickstoffatom. Das Indol-Grundgerüst kann verschiedene Seitengruppen tragen oder mit weiteren Ringen verbunden sein. Indol und viele Indol-Derivate lassen sich mit der 1883 von Emil Fischer entwickelten und nach ihm benannten Indolsynthese herstellen (Säure-vermittelte Kondensation von Ketonen mit Phenylhydrazinen).
Eine bedeutende Klasse von Indol-Derivaten sind Cyclopenta[b]indole – Verbindungen mit einem Gerüst aus einer Indol-Einheit und einem zusätzlichen Fünfring. Der Fünfring kann ein chirales Kohlenstoffzentrum enthalten: ein Ring-Kohlenstoffatom, das zusätzlich zwei verschiedene Seitengruppen trägt, die auf zwei zueinander spiegelbildliche Weisen angeordnet sein können. In der Natur kommt immer nur ein Enantiomer vor, d.h. eine der beiden Formen. Die klassische Fischer-Indolsynthese liefert jedoch ein Gemisch beider Enantiomere.
Das Team um Santanu Mukherjee und Garima Jindal vom Indian Institute of Science in Bangalore, hat jetzt eine katalytische Variante der Fischer-Indolsynthese entwickelt, die bevorzugt eines der Enantiomere liefert (d.h. enantioselektiv ist). Ausgangpunkt ist eine Klasse von Diketonen (2,2-disubstituierte Cyclopentan-1,3-Dione) und mit speziellen Schutzgruppen versehene Phenylhydrazin-Derivate. Erfolgsgeheimnis ist der spezielle Katalysator, eine chirale zyklische Phosphorsäure. Die Reaktion wird in Anwesenheit von Zinkchlorid als Co-Katalysator und einem sauren Kationen-Austauscher-Harz durchgeführt, das den als Nebenprodukt entstehenden Ammoniak abfängt.
Herzstück des Reaktionsmechanismus ist eine sogenannte dynamische kinetische Trennung: Im Verlauf der Reaktion entsteht zunächst ein chirales Hydrazon als Zwischenprodukt – in beiden enantiomeren Formen. Dieser Schritt ist reversibel, sodass sich die beiden enantiomeren Hydrazone im Verlauf der Reaktion ineinander umwandeln können. Die Weiterreaktion der Hydrazone zu den Indol-Derivaten ist die eigentliche katalytische Reaktion. Diese verläuft mit einem der Hydrazon-Enantiomere wesentlich schneller in Vergleich zum anderen. Ursache ist eine günstigere Geometrie bei der Bindung an den chiralen Katalysator. Das andere Hydrazon-Enantiomer reagiert sehr langsam, sodass nur eine kleine Menge des Indol-Produkts entsteht. Stattdessen wandelt sich das langsam reagierende Hydrazon-Enantiomer in das schnell reagierende Hydrazon-Enantiomer um, was dazu führt, dass das Gleichgewicht letztlich in Richtung des Cyclopentan[b]indol-Produkts verschoben wird.
Auf diese Weise gelang es dem Team, viele verschiedene Indol-Derivate in moderaten Ausbeuten, aber mit guter bis exzellenter Enantiomeren-Selektivität zu erhalten.