Im Zentrum der biologischen Stickstoffchemie
Das Rätsel um ein zentrales Atom in Enzymen, die Luftstickstoff spalten, ist gelöst: Es handelt sich um Kohlenstoff
Anzeigen
Wie einige Bakterien den Stickstoff der Luft in biologisch brauchbare Verbindungen umwandeln, wird nun klarer. Ein internationales Forscherteam, an dem auch Wissenschaftler des Max-Planck-Instituts für bioanorganische Chemie in Mülheim an der Ruhr beteiligt waren, hat das letzte Detail im Bauplan des enzymatischen Kofaktors aufgeklärt, mit dem die Mikroorganismen die sehr stabilen Bindungen der Stickstoffmoleküle aufbrechen. Demnach handelt es sich bei einem zentralen Atom des Enzyms um Kohlenstoff. Die Natur dieses einen Atoms ließ sich erst mit einer besonders feinfühligen Variante der Röntgen-Emissions-Spektroskopie aufdecken, die in den Biowissenschaften bislang kaum gebräuchlich ist. Die genaue Struktur des Kofaktors zu kennen, ist eine Voraussetzung, um Stickstoffverbindungen nach dem Vorbild der Natur schonender herzustellen als im industriellen Haber-Bosch-Verfahren, das mit hohem Druck und hoher Temperatur arbeitet.
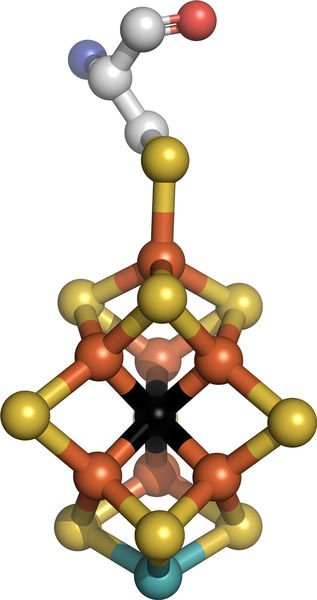
Der dunkle Fleck ist weg: Als Sauerstoffatom hat ein internationales Forscherteam das schwarz dargestellte Atom im Zentrum des Kofaktors FeMoco identifiziert. Der Kofaktor ist Teil einer Nitrogenase, einem Enzym, mit dem Bakterien Luftstickstoff spalten. (orange – Eisen, gelb – Schwefel, hellblau – Molybdän, rot – Sauerstoff, grau – Kohlenstoff, blau – Stickstoff; Wasserstoffatome sind nicht gezeigt)
© Science / Serena DeBeer
Man könnte von einem Kartell der biologischen Stickstoffchemie sprechen: Nur eine Reihe mikrobieller Spezialisten wie Knöllchen- und Cyanobakterien können den Stickstoff der Luft in Ammoniak umwandeln, aus dem sich Aminosäuren und andere stickstoffhaltige Biomoleküle aufbauen lassen. Denn nur diese Bakterien besitzen den biochemischen Apparat, um die extrem starke Dreifachbindung von Stickstoff-Molekülen zu knacken.
Die Enzyme und Kofaktoren, mit dem die Einzeller Stickstoff aus der Luft chemisch fixieren, arbeiten bei sehr milden Bedingungen und sind daher auch für Chemiker interessant. Das industrielle Haber-Bosch-Verfahren spaltet die Stickstoffmoleküle nämlich unter sehr harschen Bedingungen – bei hohem Druck und hoher Temperatur –, um daraus Ammoniak zu erzeugen. Für einen Prozess, der unter milderen Bedingungen läuft, könnten sich Chemiker den enzymatischen Apparat zum Vorbild nehmen – wenn sie seine Arbeitsweise im Detail verstünden. Ein Detail hat ein internationales Team um Serena DeBeer, die am Max-Planck-Institut für bioanorganische Chemie und an der Cornell Universität im US-amerikanischen Ithaca forscht, nun geklärt. Die Forscher haben herausgefunden, dass an einer zentralen Stelle des Eisen-Molybdän-Kofaktors, kurz FeMoco, ein Kohlenstoffatom sitzt. Bei FeMoco handelt es sich um das aktive Zentrum der Stickstoff fixierenden Nitrogenase-Enzyme. Das Kohlenstoffatom bildet mit sieben Eisenionen, neun Sulfidionen und einem Molybdänion das aktive Zentrum, an dem Stickstoffmoleküle gespalten werden.
Die Forscher haben herausgefunden, dass an einer zentralen Stelle des Eisen-Molybdän-Kofaktors, kurz FeMoco, ein Kohlenstoffatom sitzt. Bei FeMoco handelt es sich um das aktive Zentrum der Stickstoff fixierenden Nitrogenase-Enzyme. Das Kohlenstoffatom bildet mit sieben Eisenionen, neun Sulfidionen und einem Molybdänion das aktive Zentrum, an dem Stickstoffmoleküle gespalten werden.
Die Identität des zentralen Atoms war jahrelang unbekannt
„Mit unserer Untersuchung haben wir einen ersten Schritt getan, um die biologische Stickstofffixierung besser zu verstehen“, sagt Serena DeBeer. Die Forscher klärten mit ihrer Studie eine seit Jahren offene Frage. In einer Röntgenstrukturuntersuchung hatten deutsche und amerikanische Wissenschaftler den Bauplan des Kofaktors im Jahr 2002 weitgehend entschlüsselt. Über ein Atom, das in seiner Mitte sitzt und von sechs zentralen Eisenatomen umgeben ist, konnten sie aber nicht mehr sagen, als dass es sich um ein leichtes Element, wie Kohlenstoff, Sauerstoff oder Stickstoff handeln müsse.
Gelöst haben die Forscher um Serena DeBeer das Problem nun mit einer Variante der Röntgenemissionsspektroskopie: der Valence to Core X-ray Emission Spectroscopy (V2C-XES), zu Deutsch Valenz-zu-Kern-Röntgenemissionsspektroskopie. Sie nutzt Röntgensignale, die in Prozessen zwischen den Valenz- und kernnahen Elektronen der Eisenatome entstehen. Die Valenzelektronen bilden die äußerste Schale in der Elektronenhülle eines Atoms; über sie steht das Atom mit seinen Nachbaratomen in Kontakt, so dass sie von den Nachbaratomen beeinflusst werden. Dies wiederum macht sich in einem V2C-XES Spektrum bemerkbar.
Im Fall von FeMoco heißt das: Das V2C-XES-Spektrum der sechs zentralen Eisenatome gibt Aufschluss über ihre Bindungspartner und mithin über das bis dato unbekannte leichte Atom. Um dieses zu identifizieren, verglichen die Forscher ihre experimentellen Daten des FeMoco-Komplexes zum einen mit Daten eines anderen Eisen-Schwefel-Komplexes in der Nitrogenase. Dessen Zentrum ähnelt dem von FeMoco, in der Mitte seiner sechs zentralen Eisenatome sitzt allerdings bekanntermaßen ein Schwefelatom.
Nur mit Simulationen ließen sich die Röntgendaten interpretieren
Zum anderen stellten die Forscher umfangreiche Berechnungen an, um zu klären, worum es sich bei dem zentralen Atom handelt. Dabei diente ihnen der Eisen-Schwefel-Komplex mit genau bekanntem Bauplan als Referenz. „Nur dank dieser theoretischen Studien, können wir die V2C-Spektren interpretieren“, sagt Frank Neese, Direktor am Mülheimer Max-Planck-Institut. Er simulierte, wie sich die V2C-Röntgenspektren verändern, wenn an der zentralen Stelle der Nitrogenase mal ein Stickstoff-, mal ein Sauerstoff-, und mal ein Kohlenstoffatom sitzt. „Gemessenes und simuliertes Spektrum stimmten nur überein, wenn an der zentralen Stelle ein Kohlenstoffatom sitzt“, sagt Serena DeBeer.
Das grundlegende, auf der Quantenmechanik beruhende, Instrumentarium für die Simulationen hatten Neese und DeBeer bereits in Vorläufer-Arbeiten entwickelt. „Nun haben wir das Rechenprotokoll an große Biomoleküle angepasst“, so Neese. In die Rechnungen der Forscher gingen nämlich nicht nur die mehr als 20 Atome ein, aus denen FeMoco besteht. Vielmehr berücksichtigten sie auch noch die Umgebung des Kofaktors, so dass ihre Simulation insgesamt 152 Atome der Nitrogenase umfasste. „Rechnungen für so viele Atome mit so komplizierter Elektronenstruktur wären vor zehn Jahren noch nicht möglich gewesen“, sagt Frank Neese.
Mit ihrer aktuellen Arbeit lösen die Forscher nicht nur ein Rätsel der Strukturbiologie. Sie beweisen auch, wie hilfreich ihre Methode ist. „Kombiniert mit theoretischen Analysen liefert die V2C-XES-Spektroskopie Strukturinformationen, die sich mit keiner anderen Methode gewinnen lassen“, sagt Serena DeBeer. „Dennoch wird diese Variante der Röntgenemissionsspektroskopie in der Strukturbiologie bisher noch kaum angewendet.“ Das liegt auch daran, dass die V2C-XES-Signale 1000 Mal schwächer sind als die Daten der herkömmlichen Röntgenemissionsspektroskopie, die nur auf elektronischen Prozessen im Inneren eines Atoms beruht. Daher verwendeten die Forscher das sehr intensive Röntgenlicht einer Synchrotron-Quelle und wiederholten ihre Messung rund tausend Mal, um genügend Daten zu sammeln.
Wie läuft die Stickstoffspaltung im Detail ab?
Nun wollen die Wissenschaftler um Serena DeBeer mehr über die Funktionsweise von FeMoco herausfinden, und welche Rolle das zentrale Kohlenstoffatom dabei spielt. Zu diesem Zweck möchten sie auch den elektronischen Zustand des Kohlenstoffatoms genauer studieren. „Dass ein Kohlenstoffatom mit sechs Atomen interagiert, ist sehr ungewöhnlich“, so DeBeer: „Daher wird es in FeMoco sicherlich eine außergewöhnliche elektronische Struktur besitzen.“
Zudem möchten die Forscher Verbindungen untersuchen, die dem FeMoco ähneln. Und sie möchten eine Nitrogenase samt FeMoco in Aktion beobachten. Wenn das Enzym nämlich gerade ein Stickstoffmolekül verarbeitet, äußert sich dies auch in seinen spektroskopischen Daten. Daraus erfahren die Wissenschaftler Details über den Reaktionsmechanismus der biologischen Stickstofffixierung. Diese Erkenntnisse könnten ihnen wiederum helfen, eine energieeffiziente technische Methode zu entwickeln, um Stickstoff aus der Luft chemisch nutzbar zu machen.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!