Größere Tasche für Klick-Chemie
Umprogrammierte nichtribosomale Peptid-Synthetase baut Aminosäuren mit reaktiven Stellen für Klick-Chemie ein
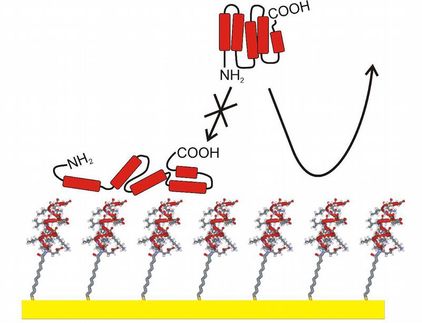
Eine einzelne gezielte Mutation genügt, um ein natürliches Peptidsynthese-System so zu verändern, dass es auch nicht-natürliche Aminosäuren in Peptide einbaut, berichten Schweizer Wissenschaftler in der Zeitschrift Angewandte Chemie. Die Mutation vergrößert die Bindungstasche innerhalb einer Domäne des Systems und variiert damit dessen Substratspezifität. Den Forschern gelang so der Einbau von Aminosäuren mit einer spezifischen reaktiven Gruppe, über die das Peptid später leicht modifiziert werden kann.
Für die Suche nach neuen Wirkstoffen mithilfe der kombinatorischen Chemie und Screeningverfahren stehen Forscher oft vor der Aufgabe, Naturstoffe zu modifizieren und zu variieren, indem sie beispielsweise mit weiteren Molekülteilen verknüpft werden. Besonders wichtig sind auch hochspezifische Kopplungen mit molekularen Markern, um die Verteilung von Naturstoffen in Zellen und Geweben beobachten zu können. Kopplungen, die fast so einfach wie per Druckknopf ablaufen, lassen sich mit der so genannten „Klick-Chemie“ verwirklichen. Diese umfasst breit anwendbare Reaktionen, z.B. zwischen Alkinen und Aziden, die hohe Ausbeuten liefern.
Der Naturstoff muss dazu zunächst mit einer solchen Alkin- oder Azid-Gruppe ausgestattet werden. Eine Möglichkeit ist der Einbau von Aminosäuren mit Alkin- oder Azid-Seitenketten in Proteine durch Eingriffe in deren Biosynthese. Viele interessante Naturstoffe, wie die Gramicidin-Antibiotika, werden jedoch nicht auf dem klassischen Wege der Proteinbiosynthese gebildet, d.h. über das Ablesen von Genen und den Zusammenbau von Aminosäuren in den Ribosomen, sondern über so genannte nichtribosomale Peptidsynthetasen, sehr große Multienzymkomplexe, deren einzelne Module wie Perlen auf einer Schnur aneinander hängen. Sie aktivieren die Aminosäure-Bausteine und bauen sie in die wachsende Peptidkette ein. Anzahl, Art und Reihenfolge der einzelnen Module bestimmen die Länge und Zusammensetzung des hergestellten, meist kurzkettigen Peptids. Da außer den gängigen Aminosäuren auch andere, teils ungewöhnliche Einzelbausteine eingebaut werden können, ist eine erstaunliche Vielfalt an Peptiden möglich.
Die Forscher von der ETH Zürich um Donald Hilvert tauschten durch Mutation eine einzelne Aminosäure in einem Modul des Herstellungsapparates für das Antibiotikum Gramicidin S aus. Variiert wurde eine so genannte A-Domäne, die die natürliche Aminosäure Phenylalanin spezifisch erkennt und aktiviert. Die Mutation schafft mehr Platz in der Bindungstasche, sodass anstelle von Phenylalanin auch nicht-natürliche Aminosäuren, die eine Azid- oder Alkin-Gruppe tragen, aktiviert und in die Peptidkette eingebaut werden. Die katalytische Aktivität des Gesamtsystems wird durch diese veränderte Selektivität nicht beeinträchtigt.
Da viele verschiedene nichtribosomale Synthese-Systeme über solche A-Domänen verfügen, ist die neue Methode ein potenziell genereller Ansatz, um wichtige Naturstoffe mit einer reaktiven Stelle für eine hochspezifische kovalente Modifikation auszustatten.
Originalveröffentlichung
Hajo Kries, Rudolf Wachtel, Anja Pabst, Benedikt Wanner, David Niquille and Donald Hilvert; Reprogramming Nonribosomal Peptide Synthetases for “Clickable” Amino Acids; Angewandte Chemie; Article first published online: 31 JUL 2014
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Synthese
Die chemische Synthese steht im Zentrum der modernen Chemie und ermöglicht die gezielte Herstellung von Molekülen mit spezifischen Eigenschaften. Durch das Zusammenführen von Ausgangsstoffen in definierten Reaktionsbedingungen können Chemiker eine breite Palette von Verbindungen erstellen, von einfachen Molekülen bis hin zu komplexen Wirkstoffen.

Themenwelt Synthese
Die chemische Synthese steht im Zentrum der modernen Chemie und ermöglicht die gezielte Herstellung von Molekülen mit spezifischen Eigenschaften. Durch das Zusammenführen von Ausgangsstoffen in definierten Reaktionsbedingungen können Chemiker eine breite Palette von Verbindungen erstellen, von einfachen Molekülen bis hin zu komplexen Wirkstoffen.