Effektiverer Katalysator mit Licht
Plasmonischer Effekt ermöglicht es Katalysator, mit geringerer Energie zu arbeiten
Anzeigen
Nanowissenschaftler der Rice University haben einen neuen Katalysator vorgestellt, der Ammoniak bei Umgebungsdruck mit nur geringer Energie in Wasserstoff umwandeln kann, vor allem aufgrund eines plasmonischen Effekts, der den Katalysator effizienter macht.
Eine Studie des Rice's Laboratory for Nanophotonics (LANP) beschreibt die neuen katalytischen Nanopartikel, die überwiegend aus Kupfer mit Spuren von Ruthenium bestehen. Tests zeigten, dass der Katalysator von einem lichtinduzierten elektronischen Prozess profitierte, der die "Aktivierungsbarriere" oder den minimalen Energiebedarf, den das Ruthenium benötigt, um Ammoniakmoleküle zu spalten, deutlich senkte.
Die Forschung wird in diesem Bereich durchgeführt, da Regierungen und Industrie Milliarden von Dollar in die Entwicklung der Infrastruktur und der Märkte für kohlenstofffreien flüssigen Ammoniakkraftstoff investieren, der nicht zur Treibhauserwärmung beiträgt. Aber die Forscher sagen, dass der plasmonische Effekt Auswirkungen über die "Ammoniakwirtschaft" hinaus haben könnte.
"Ein allgemeiner Ansatz zur Reduzierung katalytischer Aktivierungsbarrieren hat Auswirkungen auf viele Bereiche der Wirtschaft, da Katalysatoren bei der Herstellung der meisten kommerziell hergestellten Chemikalien verwendet werden", sagt LANP-Direktorin Naomi Halas, eine Chemikerin und Ingenieurin, die mehr als 25 Jahre lang Pionierarbeit für die Verwendung von lichtaktivierten Nanomaterialien geleistet hat. "Wenn andere katalytische Metalle Ruthenium in unserer Synthese ersetzen können, könnten diese plasmonischen Vorteile auf andere chemische Umwandlungen übertragen werden, was sie sowohl nachhaltiger als auch kostengünstiger macht."
Katalysatoren sind Materialien, die chemische Reaktionen beschleunigen, ohne selbst zu reagieren. Ein alltägliches Beispiel ist der Katalysator, der die schädlichen Emissionen aus dem Abgas eines Fahrzeugs reduziert. Chemieunternehmen geben jedes Jahr Milliarden von Dollar für Katalysatoren aus, aber die meisten Industriekatalysatoren funktionieren am besten bei hohen Temperaturen und hohem Druck. Die Zersetzung von Ammoniak ist ein gutes Beispiel. Jedes Ammoniakmolekül enthält ein Stickstoff- und drei Wasserstoffatome. Ruthenium-Katalysatoren werden häufig eingesetzt, um Ammoniak zu spalten und Wasserstoffgas (H2), einen Kraftstoff, dessen einziges Nebenprodukt Wasser ist, und Stickstoffgas (N2), das etwa 78 Prozent der Erdatmosphäre ausmacht, herzustellen.
Der Prozess beginnt mit dem Anhaften oder Adsorbieren des Ammoniaks am Ruthenium und geht über eine Reihe von Schritten, bei denen die Bindungen im Ammoniak nacheinander aufgebrochen werden. Die zurückgelassenen Wasserstoff- und Stickstoffatome greifen einen Partner und verlassen dann die Rutheniumoberfläche oder desorbieren. Dieser letzte Schritt erweist sich als der kritischste, da der Stickstoff eine starke Affinität zum Ruthenium hat und gerne auf der Oberfläche bleibt, was die Oberfläche daran hindert, andere Ammoniakmoleküle anzuziehen. Um sie zu verdrängen, muss dem System mehr Energie zugeführt werden.
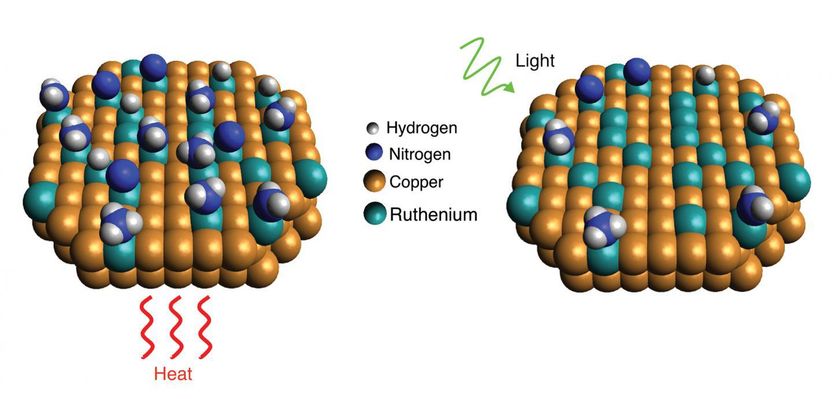
Wissenschaftler des Rice's Laboratory for Nanophotonics haben gezeigt, wie ein lichtgesteuerter Plasmoneffekt es Katalysatoren aus Kupfer und Ruthenium ermöglicht, Ammoniakmoleküle, die jeweils ein Stickstoff- und drei Wasserstoffatome enthalten, effizienter zu zerlegen. Wenn der Katalysator Licht ausgesetzt wird (rechts), erzeugen resonante plasmonische Effekte hochenergetische "heiße Träger"-Elektronen, die sich an Ruthenium-Reaktionsstellen lokalisieren und die Desorption von Stickstoff im Vergleich zu Reaktionen im Dunkeln mit Wärme beschleunigen (links).
LANP/Rice University
Der Doktorand Linan Zhou sagte, dass die Effizienz des Kupfer-Ruthenium-Katalysators von LANP von einem lichtinduzierten elektronischen Prozess herrührt, der lokalisierte Energie an Ruthenium-Reaktionsstellen erzeugt, die die Desorption unterstützt.
Der Prozess, die so genannte "heiße trägergetriebene Photokatalyse", hat seinen Ursprung im Meer der Elektronen, die sich ständig durch die Kupfernanopartikel drehen. Einige Wellenlängen des einfallenden Lichts resonieren mit dem Meer der Elektronen und erzeugen rhythmische Schwingungen, die als lokalisierte Oberflächen-Plasmonresonanzen bezeichnet werden.
Der Chemiker Zhou hat monatelang die Synthese der Kupfer-Ruthenium-Nanopartikel verfeinert, die viel kleiner sind als eine rote Blutkörperchen. Jedes Nanopartikel enthält Zehntausende von Kupferatomen, aber nur wenige tausend Rutheniumatome, die an die Stelle einiger Kupferatome auf der Partikeloberfläche treten.
"Im Grunde genommen gibt es Rutheniumatome, die in einem Meer von Kupferatomen verstreut sind, und es sind die Kupferatome, die das Licht absorbieren, und ihre Elektronen schütteln gemeinsam hin und her", sagte Swearer. "Sobald einige dieser Elektronen durch einen Quantenprozess, der als nicht-strahlender Plasmonzerfall bezeichnet wird, genügend Energie gewinnen, können sie sich innerhalb der Ruthenium-Stellen lokalisieren und katalytische Reaktionen verstärken.
"Die Raumtemperatur liegt bei etwa 300 Kelvin und Plasmonenresonanzen können die Energie dieser heißen Elektronen auf bis zu 10.000 Kelvin erhöhen, so dass, wenn sie sich auf dem Ruthenium lokalisieren, diese Energie genutzt werden kann, um die Bindungen in Molekülen aufzubrechen, bei der Adsorption und vor allem bei der Desorption zu helfen", sagte Swearer.
So wie sich ein metallischer Picknicktisch an einem sonnigen Nachmittag erwärmt, ließ das weiße Laserlicht - ein Double für Sonnenlicht in Zhou's Experimenten - auch den Kupfer-Ruthenium-Katalysator erhitzen. Da es keine Möglichkeit gibt, direkt zu messen, wie viele heiße Träger in den Partikeln erzeugt wurden, benutzte Zhou eine Wärmebildkamera und verbrachte Monate damit, akribische Messungen durchzuführen, um die thermisch induzierten katalytischen Effekte von denen, die durch heiße Träger induziert wurden, zu trennen.
"Etwa 20 Prozent der Lichtenergie wurden für die Ammoniakzersetzung aufgefangen", sagte Zhou. "Das ist gut, und wir denken, wir können verfeinern, um dies zu verbessern und effizientere Katalysatoren zu entwickeln."
Zhou und Halas sagten, dass das Team bereits an Folgeexperimenten arbeitet, um zu sehen, ob andere katalytische Metalle für Ruthenium ersetzt werden können, und die ersten Ergebnisse sind vielversprechend.
"Jetzt, da wir Erkenntnisse über die spezifische Rolle von heißen Trägern in der plasmonvermittelten Photochemie haben, schafft sie die Voraussetzungen für die Entwicklung energieeffizienter plasmonaler Photokatalysatoren für spezifische Anwendungen", sagte Halas.
Originalveröffentlichung
Zhou, Linan and Swearer, Dayne F. and Zhang, Chao and Robatjazi, Hossein and Zhao, Hangqi and Henderson, Luke and Dong, Liangliang and Christopher, Phillip and Carter, Emily A. and Nordlander, Peter and Halas, Naomi J.; "Quantifying hot carrier and thermal contributions in plasmonic photocatalysis"; Science; 2018
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Synthese
Die chemische Synthese steht im Zentrum der modernen Chemie und ermöglicht die gezielte Herstellung von Molekülen mit spezifischen Eigenschaften. Durch das Zusammenführen von Ausgangsstoffen in definierten Reaktionsbedingungen können Chemiker eine breite Palette von Verbindungen erstellen, von einfachen Molekülen bis hin zu komplexen Wirkstoffen.

Themenwelt Synthese
Die chemische Synthese steht im Zentrum der modernen Chemie und ermöglicht die gezielte Herstellung von Molekülen mit spezifischen Eigenschaften. Durch das Zusammenführen von Ausgangsstoffen in definierten Reaktionsbedingungen können Chemiker eine breite Palette von Verbindungen erstellen, von einfachen Molekülen bis hin zu komplexen Wirkstoffen.