MPG: Stellräder der "inneren Uhren" bald greifbar?
Anzeigen
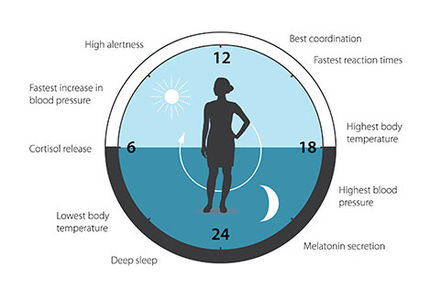
Wer auf Langstreckenflügen Zeitzonen überquert, leidet hinterher mehr oder weniger unter Jetlag. Die inneren Uhren, die in einem etwa 24-stündigen Rhythmus ticken, müssen sich plötzlich an ein ganz neues Hell-Dunkel-Schema anpassen. Während die Armbanduhr sich einfach vor- oder zurückstellen lässt, brauchen die "Zeiger" im Innern des Körpers ein wenig länger für die Umstellung. Doch es funktioniert: Nach einem oder mehreren Tagen ticken sie wieder synchron zur Außenwelt - Symptome wie Müdigkeit, Schlafstörungen, Appetitlosigkeit verschwinden. Welche molekularen Mechanismen stecken dahinter? Schon vor einigen Jahren fanden Wissenschaftler im Erbgut von Menschen und Mäusen so genannte Uhren-Gene, die für die Periodizität zuständig sind. Neue Ergebnisse zeigen nun, wie Lichtsignale von außen und Zeitverschiebungen über diese Period-Gene (Per1 und Per2) an die inneren Uhren weitergegeben werden. (Journal for Biological Rhythms, Vol. 16, April 2001, p.100-104) Dr. Albrecht und seine Arbeitsgruppe in Hannover sowie Kollegen in Houston arbeiten mit Mäusen, die sich hervorragend für Forschungen über biologische Rhythmen eignen. Die Uhren-Gene dieser Tiere sind gut charakterisiert; sie funktionieren wie eine Wasseruhr: Laufend setzt die Zelle sie in Proteine um, bis sie quasi "überläuft". Dann blockieren die Proteine ihre eigene Produktion und werden abgebaut. Dieser Kreislauf dauert eigentlich 25 Stunden, doch das Tageslicht sorgt dafür, dass die inneren Räderwerke immer wieder ein wenig nachgestellt werden und so mit der Außenwelt und dem 24-Stunden-Zyklus synchron laufen. Doch wie funktioniert diese Feinabstimmung zwischen Genen und Außenwelt, die bei extremen Zeitverschiebungen und Jetlag noch wichtiger wird? Um das herauszufinden, experimentierten die Forscher mit Knockout-Mäusen: Mit Tieren, in denen bestimmte Gene gezielt ausgeschaltet werden. Versuche mit Mäusen, die in jeweils einem der Uhrengene Per1 und Per2 oder in beiden defekt waren, wurden unterschiedlichen Lichtverhältnissen ausgesetzt. Die Aktivität der Mäuse lässt sich anhand ihrer Laufrad-Aktivität Messen. Sobald das Licht ausgeht, beginnen die nachtaktiven Säuger zu rennen. Gibt man nun Lichtpulse in der frühen oder in der späten Nacht, stellen die Mäuse sich in ihrem Zyklus um: Ihre innere Uhr reagiert auf das Signal von außen. Dabei scheinen die Per-Gene als Regulatoren wichtig zu sein; sie funktionieren quasi wie Stellrädchen an einer Armbanduhr. Die Versuche mit den Knockout-Mäusen zeigten, dass zwei Stellrädchen mit spezifischer Funktion vorhanden sind: Während Per1 die innere Uhr nach vorn verstellt, verursacht Per2 eine Verschiebung nach hinten. Gibt man den Lichtpuls beispielsweise in der frühen Nacht, denken die Tiere, der Tag sei länger und dementsprechend werden sie in der nächsten Nacht später aktiv; ein Lichtpuls gegen Morgen aber verschiebt die Uhr nach vorn. Die Gene Per1 und Per2 spielen demnach eine entscheidende Rolle, wenn es darum geht, den Organismus an einen neuen Tagesrhythmus zu gewöhnen. Jetlag nach Langstreckenflügen ist dabei nur ein Beispiel für die Bedeutung der Synchronisation zwischen äußerer Zeit und inneren Uhren. Wichtig sind diese Befunde auch für Probleme bei Schichtdienst, für Winterdepression und Syndrome wie das der vorverlagerten oder verzögerten Schlafphase. Hier könnten die Forschungen zu neuen Behandlungsansätzen führen. Ein Beweis für die Übertragbarkeit der Ergebnisse auf den Menschen: Bei Patienten, die am Syndrom der vorverlagerten Schlafphase leiden, wurde vor kurzem ein defektes Per2-Gen gefunden (Toh et. al.: Science 291, 1040-1043, 2001).