Göttinger Chemiker untersuchen spezielle Verbindungen des Lithiums
Spezielle Verbindungen des chemischen Elements Lithium haben Wissenschaftler der Universität Göttingen mit Hilfe von Röntgenstrahlung untersucht: Dabei ist es ihnen gelungen, mit der Verteilung der Elektronendichte die Bindungsverhältnisse und damit die Reaktivität des Picolyl-Lithiums aufzuklären. Diese metallorganische Lithium-Verbindung wurde bislang nie isoliert, sondern nur als Zwischenstufe für andere Produkte sofort weiter umgesetzt. Sie ist ein wichtiger Baustein zum Beispiel bei der Medikamentensynthese und in der Katalyse.
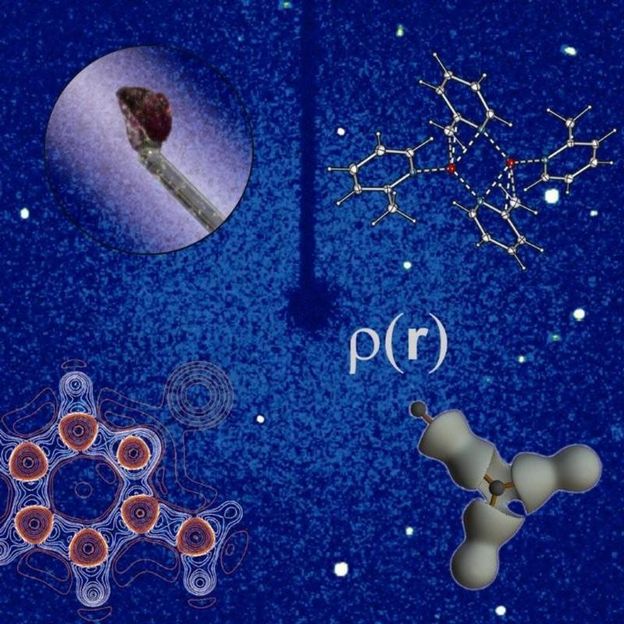
Aus dem Kristall auf einem Glasfaden (oben links) wird zunächst die Verknüpfung der Atome bestimmt (oben rechts). Aus der Elektronendichteverteilung p(r) (unten) ergibt sich dann die Reaktivität des Moleküls. Der blaue Hintergrund zeigt das Beugungsbild des Röntgenstrahls hervorgerufen vom Kristall. Dies ist die Grundlage des Experiments.
Georg-August-Universität Göttingen
Als leichtestes aller Metalle ist Lithium mit seinen besonderen Eigenschaften aus dem alltäglichen Leben nicht mehr wegzudenken: So werden beispielsweise Handys und Laptops mit umweltschonenden Lithium-Ionen-Akkus betrieben; zudem ist Lithiumcarbonat ein wirksames Medikament gegen manische Depression. Metallorganische Verbindungen des Lithiums wie das Picolyl-Lithium sind sehr energiereiche Vorstufen, die sich zur Reaktion mit weiteren chemischen Stoffen in viele Richtungen lenken lassen. Kenntnisse über die Elektronendichteverteilung in einem lithiumorganischen Molekül bieten dabei die Möglichkeit, dessen Reaktionsverhalten und damit auch das Eigenschaftsprofil eines neuen Produktes zu steuern.
Mittels Röntgenstrahlung lassen sich im Beugungsexperiment grundlegende Fragen der Lithium-Verbindungen aufklären: Wo in einem organischen Molekül wird das Lithium gebunden und welcher Natur ist diese Bindung? Wie reagiert darauf ein weiterer chemischer Stoff als hinzutretender Bindungspartner? Im Fall des Picolyl-Lithiums zeigen Molekülstruktur und Reaktivität ein auf den ersten Blick widersprüchliches Verhalten. So greift der Reaktionspartner - anders als angenommen - nicht am Ort des Lithiumatoms, sondern an einer anderen Stelle im Molekül an. Den Forschern am Institut für Anorganische Chemie ist es gelungen, dieses zunächst contraintuitiv erscheinende Phänomen mit Hilfe der Elektronendichteverteilung schlüssig zu erklären.
Originalveröffentlichung: H. Ott et al.; "Carbanion or Amide? First Charge Density Study of Parent 2-Picolyllithium"; Angew. Chem. Int. Ed. 2009, 48, 2978 - 2982
Meistgelesene News
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Chemie-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.