Der Mechanismus hinter eisbildenden Bakterien
Wie Bakterienproteine dem Gefrieren von Wasser auf die Sprünge helfen
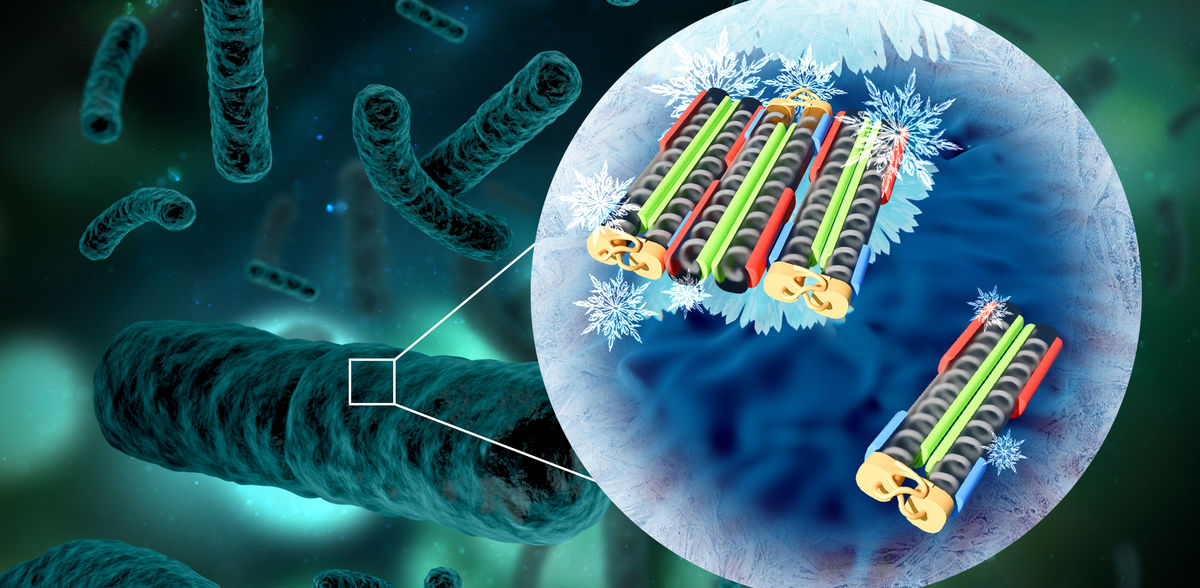
Spezielle „Eisnukleations-Proteine“, die von bestimmten Bakterien produziert werden, besitzen die Fähigkeit, den Gefrierpunkt von Wasser zu steuern – so effizient, dass kein anderes bekanntes Material mithalten kann. Wie genau diese Proteine funktionieren und wie sich ihre Aktivität gezielt steuern lässt, hat nun ein interdisziplinäres Team um Konrad Meister vom Max-Planck-Institut für Polymerforschung herausgefunden. Ihre Ergebnisse zeigen, dass bereits ein halbes Dutzend zusammengelagerte Proteine ausreicht, um maximale Aktivität zu zeigen – und sich diese unter spezifisch herbeigeführten Bedingungen bevorzugt zusammenlagern.
Damit Wasser gefriert, braucht es neben Temperaturen unter 0°C auch einen ersten Eiskeim, der den Gefrierprozess in Gang setzt. Wird dieser Eiskeim nicht gebildet, bleibt Wasser selbst bei Temperaturen bis zu -40°C flüssig – ein Phänomen, das als Unterkühlung bekannt ist. Unter den zahlreichen faszinierenden Strategien, die sich in der Natur entwickelt haben, um Unterkühlung zu vermeiden, demonstrieren bestimmte Bakterienarten besonders eindrucksvoll, wie dies gelingt. Diese nutzen spezielle „eiskeimbildende“ Proteine auf ihrer äußeren Membran, um Wassermoleküle zu eisähnlichen Strukturen zu ordnen. Damit diese Proteine jedoch als effektive Vorlagen für Eiskristalle dienen können, müssen sie sich zu Aggregaten ansammeln. Experimentelle Beobachtungen legen nahe, dass lediglich zwei verschiedene Aggregatgrößen existieren, wobei die größere dieser hochgradig angeordneten Strukturen das Gefrieren von Wasser bereits bei Temperaturen nahe 0°C ermöglicht.
Unklar war jedoch, wie viele Proteine für diese Aggregate benötigt werden und durch welchen Mechanismus sich diese überhaupt zusammenlagern. Forschende um Konrad Meister, Gruppenleiter am Max-Planck-Institut für Polymerforschung und Professor an der Boise State University (USA) sind diesen Fragen nun über einen interdisziplinären Ansatz nachgegangen. Hierfür haben sie sich die Gefrieraktivtät von Bakterien der Art „Pseudomonas syringae“ beim Abkühlen auf bis zu -30°C genaustens angeschaut und stellten fest, dass es mehr als nur die zwei ursprünglich vermuteten Aggregatgrößen gibt.
Da bislang die Struktur der Proteine nicht experimentell entschlüsselt worden ist, wurden modernste Strukturvorhersagen genutzt, um diese zu modellieren. Das Forschungsteam um Valeria Molinero, Professorin an der University of Utah, nahm dies als Grundlage für theoretische Methoden, um die benötigten Aggregatgrößen für die beobachtete Gefrieraktivität zu bestimmen.
Die Untersuchungen ergaben, dass sich zunächst äußerst stabile Dimere bilden – das sind Paare aus zwei Proteinen. Diese Dimere fungieren als grundlegende Bausteine und verbinden sich durch elektrostatische Wechselwirkungen zu größeren Strukturen. Erstaunlicherweise, reichen bereits Aggregate aus sechs Proteine aus, um den Gefrierprozess außergewöhnlich effizient einzuleiten.
Weiterhin fanden die Forschenden einen Weg, die Bildung größerer Aggregate durch Stabilisierung des pH-Wertes und Zugabe von einfachen Salzen gezielt zu fördern. Dieses Wissen ist für Anwendungen, wie der bereits etablierten Produktion von künstlichen Schnees, hochinteressant. „Zum ersten Mal konnten wir die Aktivität von bakteriellen Eisnukleatoren gezielt steigern und ihre Stabilität gegenüber schwankenden Umwelteinflüssen verbessern“, sagt Galit Renzer, Hauptautorin der Studie. „Das eröffnet nicht nur neue Möglichkeiten für innovative Anwendungen wie der Kryokonservierung, sondern liefert auch wertvolle Erkenntnisse im Umgang mit den Auswirkungen des Klimawandels.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Galit Renzer, Ingrid de Almeida Ribeiro, Hao-Bo Guo, Janine Fröhlich-Nowoisky, Rajiv J. Berry, Mischa Bonn, Valeria Molinero, Konrad Meister; "Hierarchical assembly and environmental enhancement of bacterial ice nucleators"; Proceedings of the National Academy of Sciences, Volume 121, 2024-10-17
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

AZURA Purifier + LH 2.1 von KNAUER
Präparative Flüssigkeitschromatografie - Neue Plattform für mehr Durchsatz
Damit sparen Sie Zeit und verbessern die Reproduzierbarkeit beim Aufreinigen

Holen Sie sich die Chemie-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.