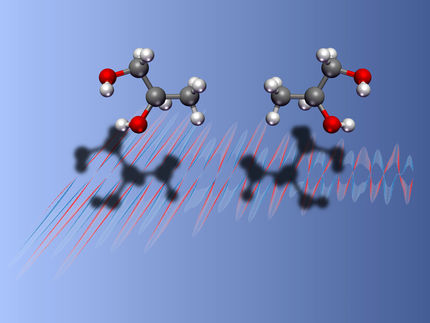
Moleküle zappeln sich ins eigene Spiegelbild
Chirale Prozesse an Oberflächen
Katalysatoren funktionieren, selbst wenn noch nicht sämtliche chemische (Teil-)Reaktionen bekannt sind, die etwa beim Reinigen von Autoabgasen ablaufen. Verstünden Forscher diese besser, liessen sich nicht nur Abgaskatalysatoren optimieren, sondern auch andere Prozesse, die sich an Oberflächen abspielen, beispielsweise wie sich Moleküle rechts- oder linkshändig - als Bild oder Spiegelbild - auf einer Oberfläche anordnen.
Dieses Wissen eröffnet nicht zuletzt der Pharmakologie beim Herstellen von Medikamenten neue Handlungsfelder.
"Wir kitzeln Moleküle", beschreibt Karl-Heinz Ernst von der Abteilung "Nanoscale Materials Science" die Experimente, mit denen er und seine Kollegen chemische Reaktionen untersuchen, die auf Oberflächen stattfinden. Im Rastertunnelmikroskop (RTM) versetzen sie einzelne Moleküle mit einem Elektronenstrahl hochpräzise in Schwingung. Denn ein RTM ist nicht nur Mikroskop, um kleinste Teilchen zu beobachten; es ist gleichzeitig auch ein äusserst empfindliches Werkzeug, mit dem sich einzelne Atome und Moleküle manipulieren lassen.
In den Experimenten der Empa-Forscher begannen die angeregten Moleküle zu hüpfen und zu zappeln, bewegten sich von der Stelle, drehten sich um ihre Achse, konnten aber auch blitzschnell "invertieren", das heisst in die gegensätzliche Spiegelbildform wechseln. Mit dem Verändern der elektrischen Spannung und und des Tunnelstroms konnten die Wissenschaftler nachvollziehen, welche Teile der Moleküle angeregt wurden und wie sie darauf reagierten.
Paare, die sich nicht zur Deckung bringen lassen
Ernst und seine Kollegen interessierte dabei ganz speziell, wie es sich mit der Spiegelbildlichkeit oder Chiralität verhält: In der Natur kommen derartige "Paare", die gleich aussehen und doch verschieden sind, und auch mit Drehen und Wenden nicht zur Deckung gebracht werden können, häufig vor. Paradebeispiele für Chiralität sind Schneckenhäuser und Mineralien, und - eben auch - Moleküle. Viele Moleküle des Lebens sind chiral, zum Beispiel DNA, Proteine und deren Bausteine, die Aminosäuren, und Zuckermoleküle.
Diese kommen fast ausschließlich in der einen Spiegelbildform vor. Warum dem so ist, bleibt ein Rätsel mit großer Tragweite: Denn die zwei Spiegelbildformen eines Moleküls können - trotz identischer physikalischer und chemischer Eigenschaften - biologisch völlig unterschiedlich wirken. So riecht beispielsweise der Duftstoff Carvon - abhängig von seiner linken oder rechten "Händigkeit" - entweder nach Minze oder nach Kümmel. Weniger harmlos wirkte sich in den 60er-Jahren die Händigkeit des Wirkstoffs Thalimdomid im Schlafmittel Contergan aus: Seine rechtshändige Form brachte den ersehnten Schlaf, das linksdrehende Thalimdomid führte bei Schwangeren zu schweren Missbildungen der Ungeborenen.
Wenn sich die Experimente nun auch noch besser modellieren liessen, und falls verstanden würde, warum Moleküle in ihre Spiegelform springen, erschlössen sich daraus nicht nur der Pharmakologie neue Syntheseverfahren.
Originalveröffentlichung: Manfred Parschau et al.; "Umwandlung der absoluten Konfiguration einzelner Adsorbatkomplexe"; Angew. Chem. 2009, 122, 4125-4129
Meistgelesene News
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

AZURA Purifier + LH 2.1 von KNAUER
Präparative Flüssigkeitschromatografie - Neue Plattform für mehr Durchsatz
Damit sparen Sie Zeit und verbessern die Reproduzierbarkeit beim Aufreinigen

Holen Sie sich die Chemie-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.