Erstmalige präzise Messung der effektiven Ladung eines einzelnen Moleküls
Entdeckung könnte den Weg zu neuen diagnostischen Werkzeugen ebnen
Zum ersten Mal ist es Forschenden gelungen, die effektive elektrische Ladung eines einzelnen Moleküls in Lösung präzise zu messen. Dieser fundamentale Fortschritt einer vom SNF unterstützten Professorin könnte den Weg für die Entwicklung neuartiger medizinischer Diagnosegeräte ebnen.
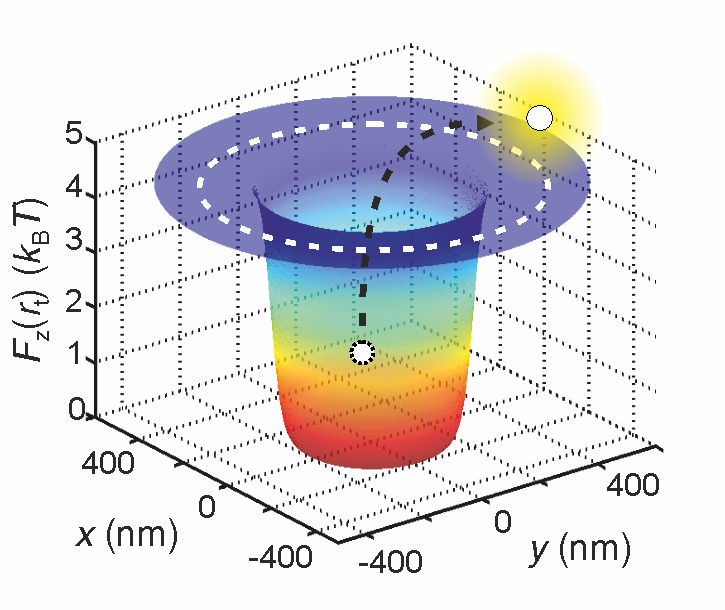
Forschende können die effektive elektrische Ladung eines Moleküls feststellen, indem sie dieses in einem Potentialtopf fangen und messen, wie lange es darin bleibt.
© Madhavi Krishnan / University of Zurich
Die elektrische Ladung ist eine der Kerneigenschaften, mit denen Moleküle miteinander in Wechselwirkung treten. Das Leben selber wäre ohne diese Eigenschaft undenkbar: Viele biologische Prozesse beruhen auf Interaktionen von Molekülen wie Proteinen, bei denen die Ladung eine entscheidende Rolle spielt. Doch die Ladung eines Proteins in einer wässrigen Umgebung – das normale Umfeld in einem lebenden Organismus – lässt sich mit herkömmlichen Ansätzen kaum genau bestimmen.
Im Rahmen einer SNF-Förderungsprofessur an der Universität Zürich hat Madhavi Krishnan eine Methode entwickelt, um die Ladung eines einzelnen Moleküls in Lösung zu messen. Ihr Vorgehen beschrieb sie in einer Reihe von Artikeln in den Fachzeitschriften Nature Nanotechnology, Physical Review E und Journal of Chemical Physics. Diese Entdeckung könnte den Weg zu neuen diagnostischen Werkzeugen ebnen, da viele Krankheiten auf molekularer Ebene damit zusammenhängen, dass ein Protein aufgrund einer veränderten elektrischen Ladung nicht mehr einwandfrei arbeitet.
Die Ladung eines Moleküls kann sich beträchtlich verändern, je nachdem, ob es sich in Gasphase oder Lösung befindet. Der Grund für diesen Unterschied liegt in den komplexen Wechselwirkungen mit den umgebenden Flüssigkeitsmolekülen. Deshalb ergeben die üblichen Gasphasemessungen keine direkten Informationen zum Verhalten des Moleküls in seinem biologischen Umfeld.
"Wie Kinder beim Ballspiel"
Moleküle in Lösung sind ständig in Bewegung, da sie dauernd und rein zufällig zusammenstossen. Krishnan und die Doktorandin Francesca Ruggeri nutzten dieses als Brownsche Bewegung bekannte Phänomen, um die effektive Ladung eines Moleküls direkt in der Lösung zu messen.
Zuerst fingen sie das Molekül in einem sogenannten Potentialtopf. Das ist die anschauliche Bezeichnung für den Zustand eines Moleküls bei minimaler potentieller Energie. Durch die fortwährenden Zusammenstösse mit den hüpfenden Wassermolekülen droht dem Molekül dabei ständig der Herauswurf aus dem Topf.
"Die Situation lässt sich mit Kindern vergleichen, die in einer Grube mit einem Ball spielen", erklärt Krishnan. "Der Ball ist das untersuchte Proteinmolekül, die Kinder sind die Wassermoleküle. Der Ball müsste einen ziemlich heftigen Tritt erhalten, um aus der Grube zu fliegen."
Je höher die effektive Ladung des Moleküls, desto grösser ist die Tiefe des Potentialtopfs und desto geringer ist folglich die Wahrscheinlichkeit, dass das Molekül aus dem Topf gestossen wird. Deshalb hängt die Zeit, bis das Molekül aus dem Topf fliegt, direkt mit der effektiven Ladung zusammen.
"Letztlich ist es ein statistisches Prinzip", erklärt Krishnan. "Wenn wir wissen, wie lange ein Molekül im Topf gefangen bleibt, wissen wir auch, wie tief der Topf ist. Und da die Topftiefe wiederum direkt von der effektiven Ladung des Moleküls abhängt, können wir diesen Wert sehr genau bestimmen."
Zwei Glasplatten
Um einen Potentialtopf zu erzeugen, komprimierten die Forschenden eine Lösung mit dem Protein zwischen zwei Glasplatten, eine davon mit mikroskopisch kleinen Löchern. Die in Potentialtöpfen gefangenen Moleküle wurden mit einem Fluoreszenzmittel markiert und liessen sich so mit einem optischen Mikroskop beobachten.
Diese Entdeckung ist für die Grundlagenforschung wichtig, sie könnte aber auch den Weg ebnen zu neuartigen diagnostischen Werkzeugen für viele Krankheiten, die mit falsch gefalteten Proteinen zusammenhängen, wie Alzheimer oder Krebs. "Wir wissen, dass die 3D-Konformation die effektive Ladung beeinflusst. Unsere Methode könnte einen neuen Ansatzpunkt bieten, um fehlerhafte Proteine nachzuweisen."
Originalveröffentlichung
F. Ruggeri et al.; "Single-molecule electrometry"; Nature Nanotechnology; 2017.
M. Krishnan; "A Simple Model for Electrical Charge in Globular Macromolecules and Linear Polyelectrolytes in Solution"; Journal of Chemical Physics; 2017.
F. Ruggeri and M. Krishnan; "Spectrally resolved single-molecule electrometry"; Journal of Chemical Physics; 2017.
F. Ruggeri and M. Krishnan; "Lattice diffusion of a single molecule in solution"; Physical Review E; 2017.

































































