Ecken und Kanten steigern Wirksamkeit von Katalysatoren
Abgas-Katalysatoren arbeiten wirksamer mit Nanopartikeln einer kantigeren Form. Das zeigt eine Untersuchung an DESYs Röntgenlichtquelle PETRA III. Forscher des DESY NanoLabs haben dafür die Umwandlung von giftigem Kohlenmonoxid zu ungiftigem Kohlendioxid an Edelmetall-Nanopartikeln live beobachtet, die auch in einem Auto-Katalysator enthalten sind. Möglichst viele Kanten zwischen den mit einem Nano-Oxid bedeckten Partikelseiten (Facetten) steigern demnach die Effizienz der Katalyse-Reaktion.
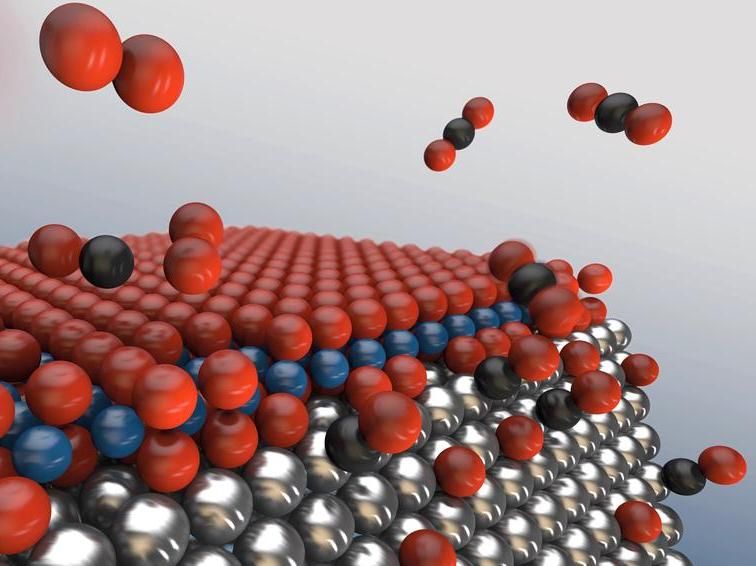
Wachsende Sauerstoffinseln (rot) auf den Metall-Nanopartikeln (silber) bremsen die erwünschte Reaktion. An den Kanten kann das Oxid keine geschlossene Schicht bilden, hier läuft die Reaktion weiter ab
DESY, Lucid Berlin
In Katalysatoren werden für gewöhnlich Nanopartikel verwendet, da sie bei gleicher Stoffmenge eine erheblich größere Oberfläche bieten, an der die katalytische Reaktion ablaufen kann. Für die hier vorgestellte Studie züchteten die Forscher im DESY NanoLab Platin-Rhodium-Nanopartikel so auf einem Substrat, dass nahezu alle Partikel dieselbe Ausrichtung und Form abgeschnittener Oktaeder (Doppelpyramiden) hatten. Die katalytischen Eigenschaften dieser Probe untersuchten die Wissenschaftler unter den typischen Arbeitsbedingungen eines Auto-Katalysators und bei verschiedenen Gaszusammensetzungen in einer Reaktionskammer im hellen Röntgenlicht von PETRA III an der Messstation P09.
Die Effizienz von Katalysatormaterialien lässt sich mit einem sogenannten Massenspektrometer messen, das den Anteil bestimmter Moleküle im Abgas anzeigt, also in diesem Fall das Verhältnis von Kohlenmonoxid, Sauerstoff und Kohlendioxid. „Wir machen quasi einen Abgastest an den Nanopartikeln“, sagt die Hauptautorin der Studie, Uta Hejral, die inzwischen an der Universität Lund in Schweden arbeitet. Dank der parallelen Ausrichtung der Nanopartikel konnten die Forscher in dieser Untersuchung auch sehen, an welcher Stelle auf der Oberfläche der Nanopartikel die Reaktion besonders effizient ablief. „Hier können wir die Reaktion wirklich auf atomarer Skala verfolgen“, betont Hejral.
Normalerweise sitzen die Edelmetall-Nanopartikel in einem Auto-Katalysator auf winzigen Substratkrümeln, die zusammenkleben und komplexe Strukturen bilden. „Das ist schwer im Röntgenlicht zu untersuchen, da die Edelmetalle nur wenige Gewichtsprozent ausmachen und vor allem die Nanopartikel ganz unterschiedlich orientiert sind“, erläutert Andreas Stierle, der leitender Wissenschaftler bei DESY und Professor für Nanowissenschaften an der Universität Hamburg ist. „Im Röntgenlicht erzeugt jedes Partikel ein Streubild, und diese Streubilder überlappen sich in unüberschaubaren Mustern. Durch die parallele Ausrichtung sind jedoch auch die Streubilder aller Nanopartikel gleich ausgerichtet und verstärken sich. Auf diese Weise lassen sich verschiedene Facetten der Nanopartikel, also ihre unterschiedlichen Oberflächen, identifizieren und gezielt beobachten.“
Die Untersuchung zeigt, dass die Reaktivität der Nanopartikel bei einem bestimmten Wert der Sauerstoffkonzentration stark ansteigt. „Das geschieht, wenn gerade genug Sauerstoff verfügbar ist, um jedes Kohlenmonoxid-Molekül zu Kohlendioxid zu oxidieren“, sagt Stierle. Oberhalb dieser Konzentration sinkt die Reaktivität langsam wieder, weil sich auf den Oberflächen der Partikel durch den Sauerstoff immer größere Oxidinseln bilden und die Reaktion behindern. Die Röntgenuntersuchung zeigt die atomare Oberflächenstruktur der Nanopartikel mit bisher unerreichter Auflösung unter Reaktionsbedingungen. Dabei ist zu sehen, dass sich die verschiedenen Kristallflächen der Nanopartikel ab einer bestimmten Sauerstoffkonzentration mit einem Sauerstoff-Rhodium-Sauerstoff-Sandwich bedecken, bis zum Schluss die Metalloberfläche quasi ganz unter diesem Nano-Oxid verschwunden ist.
„Das Oberflächenoxid bildet schließlich eine geschlossene Schicht auf den Nanopartikeln“, berichtet Hejral. „Das ist zunächst ungünstig für die gewünschte Reaktion, weil sich dann nur noch schwer Kohlenmonoxidmoleküle anlagern können. An den Kanten zwischen den Facetten der Nanopartikel kann der Sauerstoff aber keine geschlossene Schicht bilden, was zu einer erhöhten Reaktivität der Kanten führt.“ Diese Erkenntnis liefert einen direkten Weg zu wirksameren Katalysatoren: „Es ist zu erwarten, dass der Katalysator umso effizienter wird, je mehr Kanten die Nanopartikel im Verhältnis zu ihrer Oberfläche haben“, sagt Stierle. Diese Erkenntnis lasse sich voraussichtlich auch auf viele andere katalytische Reaktionen übertragen. Wie stark sich dadurch die Effizienz steigern lässt, müssen weitere Untersuchungen zeigen.
































































