Die verborgene Struktur des Periodensystems
Die bekannte Darstellung der chemischen Elemente ist nur ein Beispiel, wie sich Objekte ordnen und klassifizieren lassen
Das Periodensystem der Elemente, das die meisten Chemiebücher abbilden, ist ein Spezialfall. Denn bei dieser tabellarischen Übersicht der chemischen Elemente, die auf Dmitri Mendelejew und Lothar Meyer zurückgeht, und den Ansätzen anderer Chemiker, die Elemente zu organisieren, handelt es sich um unterschiedliche Darstellungsformen einer verborgenen Struktur der chemischen Elemente. Zu diesem Schluss kommen Forscher des Leipziger Max-Planck-Instituts für Mathematik in den Naturwissenschaften und der Universität Leipzig in einer aktuellen Arbeit. Der mathematische Ansatz der Leipziger Wissenschaftler ist sehr allgemein und kann je nach Ordnungs- und Klassifikationsprinzip viele unterschiedliche Periodensysteme liefern – nicht nur für die Chemie, sondern auch für viele andere Wissensgebiete.
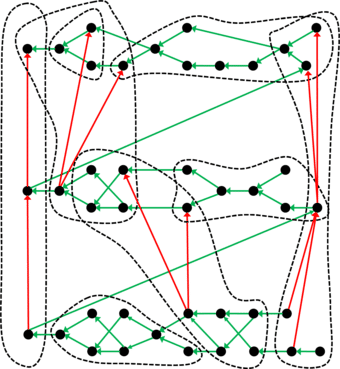
Periodensystem mal anders: Die Tafel der chemischen Elemente, die auf Dmitri Mendelejew und Lothar Meyer zurückgeht, ist nur ein Beispiel dafür, dass sich Objekte – in dem Fall die chemischen Elemente – in einem solchen System organisieren lassen. Die generelle Struktur eines Periodensystems veranschaulichen Leipziger Forscher mit diesem Beispiel: Die schwarzen Punkte stellen die Objekte dar, die durch die grünen Pfeile geordnet werden. Anhand eines geeigneten Kriteriums lassen sich die Objekte in Gruppen klassifizieren (gestrichelte Linien), in denen die roten Pfeile eine Unterordnung schaffen.
© Guillermo Restrepo, MPI für Mathematik in den Naturwissenschaften
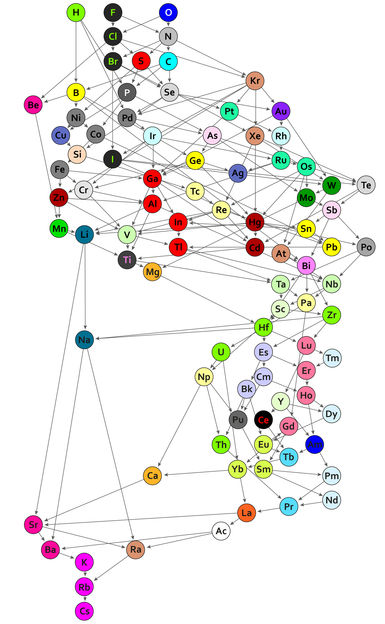
Ein Periodensystem chemischer Verbindungen: Jeder der 94 Kreise mit chemischen Elementsymbolen repräsentiert die Bindung, die das jeweilige Element mit einem organischen Rest eingeht. Geordnet werden die Bindungen danach, wie stark sie polarisiert sind. Wo es ein direkte Pfeil-Verbindung gibt, ist die Ordnung klar: Bindungen von Wasserstoff sind zum Beispiel stärker polarisiert als Bindungen von Bor, Phosphor und Palladium. Das Gleiche gilt für Rubidium im Vergleich zu Cäsium, das besonders gering polarisierte Bindungen aufweist und darum im neuen Periodensystem ganz unten steht. Gibt es keinen direkten Pfeil zwischen zwei Elementen, lassen sie sich unter Umständen dennoch vergleichen – wenn es eine Kette von Pfeilen zwischen ihnen gibt. So sind die Bindungen von Sauerstoff beispielsweise stärker polarisiert als die Bindungen von Brom. Bindungen, die mit derselben Farbe dargestellt sind, gleichen sich in ihrem Bindungsverhalten und gehören zu einer von 44 Klassen.
© Guillermo Restrepo, MPI für Mathematik in den Naturwissenschaften
Es ist eine Ikone der Naturwissenschaft und hängt in den meisten Chemie-Lehrsälen: das Periodensystem der Elemente, das in diesem Jahr seinen 150. Geburtstag feiert. Die tabellarische Übersicht ist eng mit den Namen von Dmitri Mendelejew und Lothar Meyer verbunden – zwei Forschern, die in den 1860er-Jahren eine Anordnung von Elementen geschaffen haben, die auf ihren Atommassen und Ähnlichkeiten basiert. Heute sind sie nach der Ordnungszahl sortiert, die die Zahl der Protonen im Atomkern angibt – vom leichten Wasserstoff (ein Proton) bis zum exotischen Oganesson (118 Protonen). Außerdem sind die Elemente in Gruppen klassifiziert: Atome in der gleichen Spalte haben in der Regel dieselbe Zahl von Elektronen in der äußeren Schale ihrer Elektronenhülle.
Periodensysteme in unterschiedlichen Varianten
Auf den ersten Blick scheint das Periodensystem damit eine eindeutige und endgültige Ordnung in die derzeit bekannten 118 Elemente gebracht zu haben. Aber der Schein trügt, denn manches ist bis heute umstritten: So ist man sich unter Wissenschaftler nicht einig, welche Elemente genau in die dritte Gruppe unterhalb von Scandium und Yttrium gehören. Diskutiert wird beispielsweise über die richtige Position von Lanthan und Actinium. Wer also genauer hinsieht, wird in Klassenzimmern, Hörsälen und Lehrbüchern leicht unterschiedliche Varianten des Periodensystems entdecken.
Guillermo Restrepo und Wilmer Leal, die am Max-Planck-Institut für Mathematik in den Naturwissenschaften und an der Universität Leipzig, wundert das nicht. Für sie gibt es keine eindeutig richtige Anordnung der Elemente, denn je nach dem angewandten Kriterium für die Klassifizierung ergibt sich eben ein anderes Periodensystem. So kann man die Atome unter anderem nach der Elektronenkonfiguration, also der Zahl und Anordnung ihrer Elektronen, ihrem chemischen Verhalten, ihrer Löslichkeit oder ihrem Vorkommen in geologischen Lagerstätten unterteilen. Heute hat sich zwar weitgehend durchgesetzt, die chemischen Elemente nach ihrer Ordnungszahl aneinander zu reihen und nach ihrer Elektronenkonfiguration in Gruppen einzuteilen. Doch selbst von diesem Periodensystem gibt es zahlreiche unterschiedliche Darstellungsformen, etwa als Spirale mit verschiedenen mehr oder weniger großen Ausbuchtungen, pyramidenförmig oder als dreidimensionale Blüte.
Eine gemeinsame Struktur
Die Vieldeutigkeit des Periodensystems haben Guillermo Restrepo und Wilmer Leal nun systematisch untersucht. Dabei sind zu Erkenntnissen gelangt, die auch über die Chemie hinaus von Bedeutung sind. Demnach liegt allen Darstellungsformen der chemischen Elemente eine gemeinsame Struktur zu Grunde, die Mathematiker als geordneten Hypergraph bezeichnen. Das ehrwürdige Periodensystem von Mendelejew und Meyer bietet somit nur eine Repräsentation der allgemeinen Struktur, die Guillermo Restrepo und Wilmer Leal nun postulieren. Aus dieser lassen sich jederzeit auch neue Anordnungen ableiten. Guillermo Restrepo vergleicht die Ordnung der chemischen Elemente daher mit einer Skulptur, auf die Licht aus verschiedenen Richtungen fällt. „Die verschiedenen Schatten, die die Figur dabei wirft, sind die Periodentafeln. Daher gibt es auch so viele Möglichkeiten, diese Tabellen aufzustellen. In gewisser Weise sind die Periodentafeln Projektionen. Projektionen des inneren Aufbaus des Periodensystems.“
Die verborgene mathematische Struktur, die den bekannten Periodensystemen der Chemie zugrunde liegt, versuchen die Leipziger Wissenschaftler nun zu bestimmen. Einstweilen haben sie drei Bedingungen definiert, die erfüllt sein müssen, um ein Periodensystem aufzustellen. Klar, zunächst benötigt man Objekte, die geordnet werden sollen: Bei Mendelejew, Meier und den Schöpfern der andere bekannten Periodensysteme der Chemie sind das die chemischen Elemente. Diese Objekte müssen sich anhand einer Eigenschaft ordnen lassen, also etwa nach der atomaren Masse oder der Ordnungszahl, also der Zahl der Protonen. Schließlich ist ein Kriterium nötig, um die Objekte in Klassen zusammenzufassen. Mendelejew und Meier verwendeten dafür die chemische Ähnlichkeit.
Periodisches System von chemischen Bindungen
„Wenn diese drei Bedingungen erfüllt sind, lassen sich Periodensysteme auch für andere chemische Objekte erstellen und sogar für Objekte außerhalb der Chemie“, sagt Guillermo Restrepo. Das zeigen er und Wilmer Leal, indem sie als Objekte beispielhaft die chemischen Bindungen zwischen Atomen von 94 Elementen und verschiedenen Partnern betrachten. Diese ordnen sie nach der Elektronegativität des betrachteten Elements und seinem Atomradius in dieser Bindung. Fluor, Chlor oder Sauerstoff etwa sind sehr elektronegativ und nehmen in Verbindungen relativ kleine Atomradien an. Die Bindungen klassifizieren sie dann danach, ob sie sich ähneln.
„Wir haben fast 5.000 Substanzen untersucht, die aus zwei Elementen in unterschiedlichen Anteilen bestehen“, erklärt Guillermo Restrepo. „Dann haben wir nach Ähnlichkeiten in diesen Daten gesucht. Zum Beispiel sind Natrium und Lithium ähnlich, weil sie sich mit jeweils den gleichen Elementen im selben Mengenverhältnissen verbinden – beispielsweise mit Sauerstoff oder Chlor, Brom und Jod. So haben wir Muster gefunden, mit denen sich die Elemente klassifizieren lassen.“
Ein Netz statt einer Matrix
Bei den 44 Klassen der chemischen Verbindungen gibt es manche Ähnlichkeiten mit den Hauptgruppen von Mendelejews und Meiers Periodensystem. So finden sich beispielsweise die Alkalimetalle Natrium und Lithium in einer Gruppe, weil sie mit Halogenen wie Chlor oder Fluor die gleichen einfachen Salze bilden. Auch die Bindungen der vier Halogene Fluor, Chlor Brom und Iod finden sich wie die Elemente selbst in einer Gruppe wieder. Es gibt aber auch Einteilungen, die sich von der im herkömmlichen Periodensystem deutlich unterscheiden. Kohlenstoff und Silicium finden sich nun beispielsweise nicht mehr in einer Klasse, weil sie ganz unterschiedliche Verbindungen eingehen.
Auch die Darstellung des Periodensystems der chemischen Bindungen hat nun nichts mehr mit der bekannten matrixähnlichen Anordnung der klassischen Periodensysteme der Elemente zu tun. Stattdessen werden die 94 kovalenten Bindungen in einem Netz unterschiedlich gefärbter Kreise repräsentiert, wobei jeder Kreis für eine chemische Bindung steht und die Farbe die Zugehörigkeit zu einer der 44 Gruppen symbolisiert. Da für die Sortierung nun zwei Kriterien herangezogen werden, gibt es keine eindeutige Reihenfolge der Atome mehr wie noch bei Mendelejew und Meyer – Mathematiker sprechen von einer Teilordnung. Die Kreise sind darum durch einen Pfeil oder mehrere mit anderen Kreisen verbunden, wodurch ein geordneter Hypergraph entsteht.
Periodensysteme in anderen Wissenschaften
Die chemischen Elemente und ihre Verbindungen lassen sich auch in ganz anderen Periodensystemen darstellen – je nach dem zugrundeliegenden Ordnungs- und Klassifikationsprinzip. Und mehr noch: Auch die Objekte zahlreicher anderer Wissenschaften und deren Anwendungen lassen sich in Periodensystemen ordnen. So nutzt man geordnete Hypergraphen etwa in Informationssystemen und im Web-Mining. Mögliche periodische Systeme ergeben sich zudem bei der Betrachtung von Staaten, die nach sozialen oder wirtschaftlichen Indikatoren geordnet und nach geographischer Nähe oder kultureller Ähnlichkeit klassifiziert werden können. Andere Beispiele finden sich im Ingenieurwesen, in den Umweltwissenschaften, in der Soziologie und vielen weiteren Fachrichtungen. Die Wissenschaftler untersuchen periodische Systeme also nicht nur aus Interesse an der Chemie, sondern vor allem wegen ihrer Anwendungen in vielen anderen Disziplinen.
































































