Röntgenstrahlen machen sichtbar, wie eine der stärksten Bindungen der Natur bricht
Studie löst ein vierzig Jahre altes Rätsel: Entscheidender Schritt zur Umwandlung von Methan in nützliche Chemikalien
Der Einsatz kurzer Röntgenlichtblitze bringt Wissenschaftler der Entwicklung besserer Katalysatoren zur Umwandlung des Treibhausgases Methan in eine weniger schädliche Chemikalie einen großen Schritt näher. Das in der Fachzeitschrift Science veröffentlichte Ergebnis zeigt zum ersten Mal, wie Kohlenstoff-Wasserstoff-Bindungen von Alkanen aufbrechen und wie der Katalysator bei dieser Reaktion funktioniert.
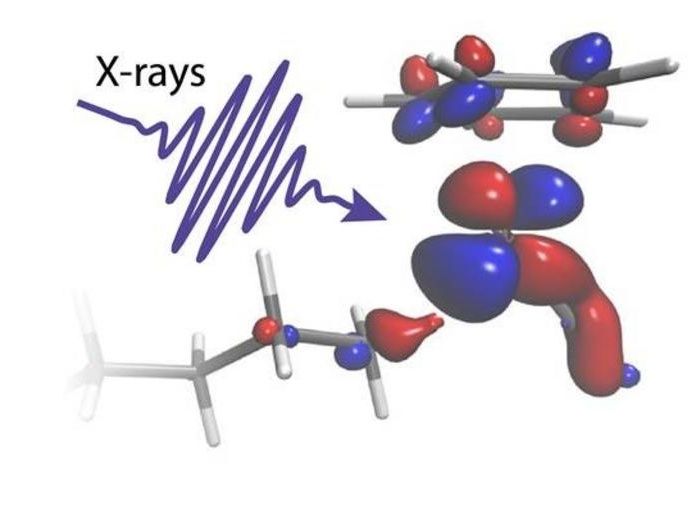
Ein Röntgenblitz beleuchtet ein Molekül
Raphael Jay

Raphael Jay, Forscher an der Fakultät für Physik und Astronomie der Universität Uppsala
Mikael Wallerstedt

Philippe Wernet, Professor an der Fakultät für Physik und Astronomie, Universität Uppsala
Mikael Wallerstedt
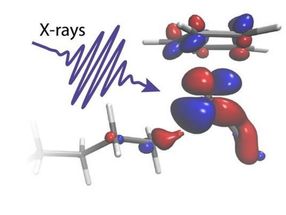


Methan, eines der stärksten Treibhausgase, wird durch die Viehzucht und das fortschreitende Auftauen des Permafrosts immer häufiger in die Atmosphäre freigesetzt. Durch die Umwandlung von Methan und längerkettigen Alkanen in weniger schädliche und sogar nützliche Chemikalien könnten die damit verbundenen Gefahren beseitigt werden, wodurch wiederum ein riesiger Rohstoff für die chemische Industrie zur Verfügung stünde. Die Umwandlung von Methan erfordert jedoch in einem ersten Schritt das Aufbrechen einer C-H-Bindung, einer der stärksten chemischen Bindungen in der Natur.
Vor vierzig Jahren wurden molekulare Metallkatalysatoren entdeckt, die C-H-Bindungen leicht spalten können. Man fand heraus, dass nur ein kurzer Blitz von sichtbarem Licht nötig war, um den Katalysator "einzuschalten", und wie von Zauberhand werden die starken C-H-Bindungen von Alkanen, die in der Nähe vorbeigehen, fast ohne jeglichen Energieaufwand gebrochen. Trotz der Bedeutung dieser so genannten C-H-Aktivierungsreaktion war jahrzehntelang unbekannt, wie der Katalysator diese Funktion ausführt.
Die Forschungsarbeiten wurden von Wissenschaftlern der Universität Uppsala in Zusammenarbeit mit dem Paul Scherrer Institut in der Schweiz, der Universität Stockholm, der Universität Hamburg und dem European XFEL in Deutschland durchgeführt. Zum ersten Mal konnten die Wissenschaftler dem Katalysator direkt bei der Arbeit zusehen und zeigen, wie er diese C-H-Bindungen spaltet.
In zwei Experimenten, die am Paul Scherrer Institut in der Schweiz durchgeführt wurden, konnten die Forscher den heiklen Austausch von Elektronen zwischen einem Rhodium-Katalysator und einer Oktan-C-H-Gruppe verfolgen, während diese aufgebrochen wird. Mit Hilfe von zwei der weltweit stärksten Quellen für Röntgenblitze, dem Röntgenlaser SwissFEL und dem Röntgensynchrotron Swiss Light Source, konnte die Reaktion von Anfang bis Ende verfolgt werden. Die Messungen zeigten die anfängliche lichtinduzierte Aktivierung des Katalysators innerhalb von 400 Femtosekunden (0,0000000000004 Sekunden) bis zum endgültigen Bruch der C-H-Bindung nach 14 Nanosekunden (0,000000014 Sekunden).
"Die von uns durchgeführten zeitaufgelösten Röntgenabsorptionsexperimente sind nur an Grossanlagen wie dem SwissFEL und der Lichtquelle Schweiz möglich, die extrem helle und kurze Röntgenpulse liefern. Der Katalysator ist in eine dichte Oktanlösung eingetaucht, aber durch die Perspektive des Metalls konnten wir gezielt die eine C-H-Bindung aus Hunderten von Tausenden heraussuchen, die zum Brechen gebracht wird", erklärt Raphael Jay, Forscher an der Universität Uppsala und leitender Experimentator der Studie.
Um die komplexen experimentellen Daten zu interpretieren, haben sich Theoretiker der Universität Uppsala und der Universität Stockholm zusammengetan und fortgeschrittene quantenchemische Berechnungen durchgeführt.
"Unsere Berechnungen ermöglichen es uns, klar zu erkennen, wie die elektronische Ladung zwischen dem Metallkatalysator und der C-H-Gruppe in genau dem richtigen Verhältnis fließt. Wir können sehen, wie Ladung, die vom Metall auf die C-H-Bindung fließt, die beiden chemischen Gruppen zusammenklebt. Ladung, die in die entgegengesetzte Richtung fließt, wirkt dagegen wie eine Schere, die das C- und das H-Atom schließlich auseinanderreißt", erklärt Ambar Banerjee, Postdoktorand an der Universität Uppsala und leitender Theoretiker der Studie.
Die Studie löst ein vierzig Jahre altes Rätsel darüber, wie ein aktivierter Katalysator tatsächlich starke C-H-Bindungen aufbrechen kann, indem er vorsichtig Bruchteile von Elektronen austauscht, ohne dass große Temperaturen oder Drücke erforderlich sind. Mit ihrem neuen Werkzeug in der Hand wollen die Forscher als Nächstes lernen, wie man den Elektronenfluss lenken kann, um bessere Katalysatoren für die chemische Industrie zu entwickeln, damit aus Methan und anderen Alkanen etwas Brauchbares entsteht.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.