Ammoniaksynthese unter milden Bedingungen
Chemiker überwinden wichtige Hürde
Pflanzen benötigen Stickstoff für ihr Wachstum, sind allerdings nicht in der Lage, das in der Atmosphäre nahezu unbegrenzt verfügbare N2-Gas zu verwerten. Hierzu sind sie vielmehr auf symbiotisch lebende Mikroorganismen angewiesen, die Luftstickstoff mit Hilfe des Enzyms Nitrogenase in Ammoniak (NH3) umwandeln („Stickstofffixierung“) und den Boden mit pflanzlich nutzbaren Ammoniumverbindungen anreichern. Die Leistungsanforderungen der modernen Agrarwirtschaft lassen sich jedoch nur durch zusätzliche Versorgung des Bodens mit erheblichen Mengen stickstoffhaltiger Düngemittel erreichen. 90 Prozent der weltweit eingesetzten Düngemittel werden aus Ammoniak hergestellt, dessen industrielle Produktion nach dem Haber-Bosch-Verfahren mehr als ein Prozent des Weltenergieverbrauchs verschlingt. Auf dem Weg zur Entwicklung leistungsfähiger Katalysatoren zur energieeffizienteren industriellen Stickstofffixierung hat ein Team von Chemikern der Goethe-Universität und der Universität Erlangen nun eine wichtige Hürde genommen.
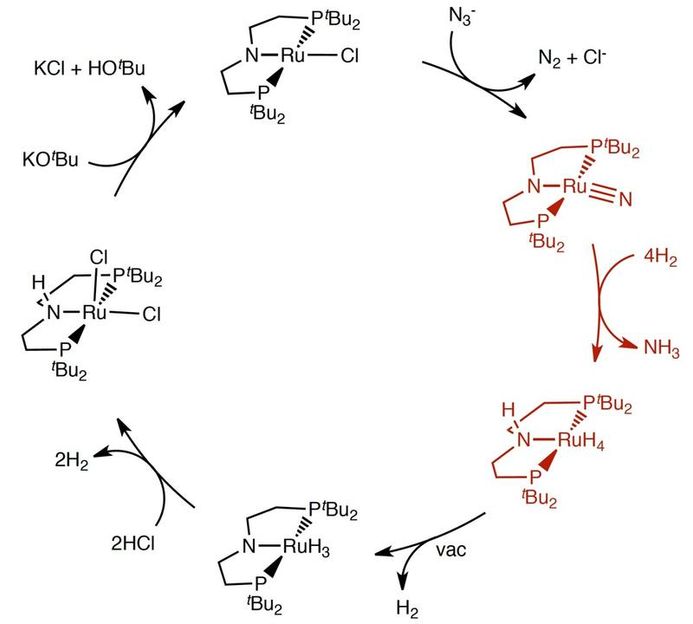
Reaktionszyklus der Ammoniaksynthese aus einem Azid und Wasserstoffgas unter milden Bedingungen.
„Wegen der ausgeprägten Reaktionsträgheit von Luftstickstoff gelingt die Reaktion mit Wasserstoff in der industriellen Ammoniaksynthese derzeit nur unter drastischen Bedingungen – aktuelle Prozesse benötigen Temperaturen von 450 °C und Drücke von 300 bar“, erklärt Prof. Max Holthausen vom Institut für Anorganische und Analytische Chemie der Goethe-Universität. „Angesichts der milden Bedingungen, unter denen Bodenbakterien diesen Prozess durchführen, stellt die Entwicklung eines chemisch-technischen Analogons seit langer Zeit ein wichtiges Forschungsgebiet für die metallorganische Chemie dar.“
Für die synthetische Herstellung von Ammoniak sind zwei gewaltige Hürden zu überwinden: Zunächst muss das N2-Gas aus der Luft durch Spaltung der äußerst starken Dreifachbindung in N2 an einem Metallzentrum chemisch aktiviert werden. Im Anschluss müssen so gebildete, metallgebundene N-Atome („Nitride“) mit Wasserstoff zur Reaktion gebracht werden („Hydrogenolyse“), so dass NH3 gebildet wird. „Dabei tritt ein grundsätzliches Dilemma auf“, so Prof. Sven Schneider vom Lehrstuhl für Anorganische und Allgemeine Chemie der Universität Erlangen-Nürnberg: „Gelingt die N2-Spaltung im ersten Schritt, so ist das gebildete Nitrid in der Regel derart stabil, dass es gar nicht erst weiterreagiert.“ Während der erste Schritt in der Vergangenheit unter milden Bedingungen realisiert werden konnte, waren für den zweiten Reaktionsschritt bislang keine Beispiele bekannt.
In einer kombinierten experimentellen und theoretischen Studie berichtet das Forscherteam nun erstmalig über die Reaktion eines Metallnitrids mit Wasserstoff zu Ammoniak unter sehr milden Reaktionsbedingungen (50 °C, 1 bar H2-Druck). Der Schlüssel zum Erfolg liegt in der Verwendung eines Metallkatalysators mit „kooperativem Pinzettenliganden“. Die quantenchemische Analyse des Reaktionsgeschehens zeigt, dass die Spaltung der H-H Bindung nicht allein am Metallzentrum des Katalysators erfolgt, sondern dass das Zusammenwirken mehrerer Bausteine des Katalysators die Reaktion drastisch beschleunigt. Die gegenwärtig verwendeten Katalysatoren erlauben noch nicht die Verwendung von N2-Gas als Stickstoffquelle, sondern verwenden hierzu Azide (s. Abbildung). Aus Sicht der Grundlagenforschung stellt diese Arbeit allerdings einen Meilenstein zur Realisierung einer chemisch-technischen Variante der Stickstofffixierung dar und weist neue Wege zur Entwicklung von Katalysatoren für die Herstellung von Ammoniak aus N2 und H2 unter milden Reaktionsbedingungen.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Chemie-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.