Moleküle in Bewegung
Viele Funktionen von Biomolekülen können erst verstanden werden, wenn die Dynamik ihrer Bewegungen unter zellähnlichen Bedingungen bekannt ist. Forscher aus Innsbruck und New York setzen ein hochmodernes Verfahren ein, mit dem sie das dynamische Verhalten einzelner Biomoleküle sehr genau ermitteln können. Es liefert wichtige Einsichten in die Funktionsweise von Genschaltern.
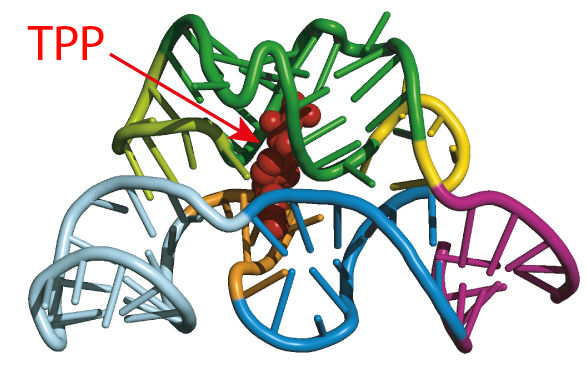
Riboschalter regulieren die Biosynthese und den Transport des Metaboliten Thiaminpyrophosphat (TPP).
Uni Innsbruck
Die DNA hat eine kleine Schwester, die Boten-RNA. Diese transportiert die Erbgut-Information in die Proteinfabriken der Zelle. Im Jahr 2000 entdeckten Wissenschaftler um Ronald R. Breaker, dass die Boten-RNA Kontrollelemente enthalten kann, mit denen diese Moleküle ihr eigenes Gen ein- oder ausschalten können. Bakterien dient dies zum Beispiel dazu, viele Stoffwechselvorgänge zu regulieren. So passen sie ihre Produktionsmaschinerie dem aktuellen Bedarf in einer Zelle an. Diese sogenannten Riboschalter haben auch das Interesse der Arbeitsgruppe um Prof. Ronald Micura am Institut für Organische Chemie und dem Centrum für Molekulare Biowissenschaften der Universität Innsbruck (CMBI) geweckt. Gemeinsam mit Wissenschaftlern des Weill Cornell Medical College in New York nutzen sie eine neue Technik, den Single-Molecule Fluorescence Resonance Energy Transfer (smFRET), um die Dynamik einzelner Riboschalter-Moleküle zu untersuchen. „Die biologische Aktivität eines Molekül erschließt sich selten nur aus der chemischen Struktur“, sagt Ronald Micura. „Entscheidend ist meist, wie sich diese Struktur im Laufe der Zeit ändert, also die Beweglichkeit des Moleküls.“
Mit üblichen Syntheseverfahren ist es nämlich kaum möglich, mehr als 50 Basenbausteine gezielt zusammenzusetzen. Micura und seine Mitarbeiter haben ein raffiniertes Verfahren entwickelt, mit dem sie chemisch synthetisierte RNA-Teile nach Belieben kombinieren können. Sie greifen dabei auf einen Trick der Natur zurück: Bestimmte Enzyme können RNA-Strangbrüche reparieren, indem sie die Teile durch chemische Bindungen wieder aneinanderfügen. Bietet man diesen Enzymen die künstlich hergestellte RNA an, knüpfen sie auch daraus lange Ketten. So bilden die Chemiker natürliche Riboschalter nach und markieren diese an den entscheidenden Stellen mit Farbstoffen. Im Labor der New Yorker Forscher werden diese oft in monatelanger Feinarbeit hergestellten Riboschalter dann mit Hilfe von Laserlicht analysiert.
Auf größere biomolekulare Maschinen ausweiten
In PNAS haben die Forscher nun Ergebnisse der Untersuchung eines der verbreitetsten Riboschalter-Moleküle veröffentlicht. Diese kommen in Bakterien, Pflanzen und Pilzen vor und regulieren die Biosynthese und den Transport des Metaboliten Thiaminpyrophosphat (TPP), einem Abkömmling von Vitamin B1. Mit dem neuen Verfahren können die Forscher die Bewegungen einzelner Moleküle im Millisekundentakt beobachten.
„Wir waren sehr überrascht zu sehen, wie beweglich die beiden Arme des Moleküls sind, welche in der Kristallstruktur eine starre Interaktion implizieren“, erzählt Micura. „Dort liegt auch die Bindetasche des Metaboliten, der an die RNA andockt und das entsprechende Gen abschaltet.“ Möglich ist diese genaue Beobachtung nur durch die selektive Modifizierung der RNA-Moleküle in den Innsbrucker Labors. Micura und sein amerikanischer Partner haben sich das entsprechende Verfahren in der Zwischenzeit auch patentieren lassen und wollen nun in einem gemeinsamen, von der National Science Foundation NSF und dem Wissenschaftsfonds FWF geförderten Projekt ihre Techniken auch auf noch größere Biomoleküle ausweiten. „Wir wollen den gesamten Translations-Mechanismus - als jene Maschinerie, die aus Erbgutinformation Proteine erzeugt - untersuchen“, blickt Micura bereits in die Zukunft.
Originalveröffentlichung
Meistgelesene News
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Chemie-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.




























































