Innovative Technik eröffnet neue Analysemöglichkeiten für Biomoleküle
Forscher untersuchen winzige Proteinkristalle mit Synchrotronstrahlung
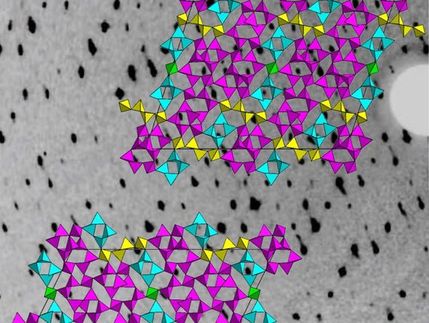
Wissenschaftler des Center for Free-Electron Laser Science (CFEL), des Europäischen Molekularbiologischen Laboratoriums (EMBL) sowie der Universitäten Hamburg und Lübeck haben bei DESY neue Analysemöglichkeiten für empfindliche Biomoleküle geschaffen. An der Röntgenquelle PETRA III durchleuchteten die Forscher mikrometerfeine Kristalle eines Schlüsselenzyms der Schlafkrankheit und konnten auf diese Weise seine atomare Struktur bestimmen. Die so gewonnenen Strukturdaten decken sich mit früheren Analysen desselben Enzyms am weltstärksten Röntgenlaser in Stanford (USA). "Da nur sehr wenige der kostbaren Kristalle benötigt werden, eröffnet dieser Ansatz neue Möglichkeiten für die Strukturanalyse von Biomolekülen", betont CFEL-Forscher Cornelius Gati, Erstautor einer Studie, die das neue Verfahren im Fachjournal der Internationalen Union für Kristallographie, "IUCrJ", beschreibt.
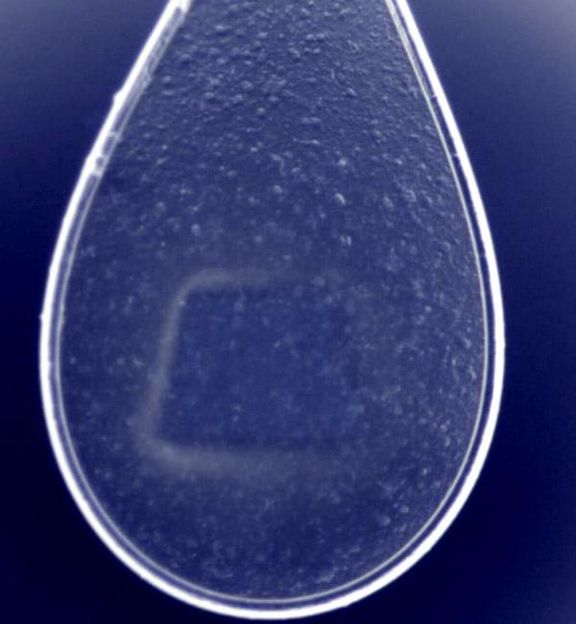
Die Nylonschlinge enthält einen dünnen Film mit Mikrokristallen, die vom Röntgenstrahl abgerastert werden.
DESY
Aus der atomgenauen Struktur eines Biomoleküls können Biologen seine Funktionsweise und Eigenschaften bestimmen. Auf diesem Weg lassen sich beispielsweise maßgeschneiderte Medikamente entwerfen. Um die hochkomplexen Moleküle zu entschlüsseln, nutzen Forscher die Röntgen-Kristallographie. Dazu beleuchten sie Kristalle aus Biomolekülen mit kurzwelliger Röntgenstrahlung. Aus der Art und Weise, wie diese Kristalle das Röntgenlicht ablenken, lässt sich mit ausgeklügelten Rechenverfahren die Struktur der Kristalle und damit der Moleküle bestimmen. "Das Prinzip lässt sich als eine Art mathematische Lupe erklären", beschreibt Gati das Verfahren, das vor rund 100 Jahren vom deutschen Röntgenpionier Max von Laue sowie von den Briten William Henry Bragg und William Lawrence Bragg begründet wurde und heute routinemäßig bei Stoffen aus verschiedensten Fachrichtungen zum Einsatz kommt.
Im Gegensatz zu anderen Materialien lassen sich viele Biomoleküle jedoch nur schwer kristallisieren. "Es ist ein enormer Aufwand, von komplizierten Proteinen ausreichend große Kristalle für Standardanalysen zu züchten", betont Lars Redecke vom gemeinsamen Laboratorium für Strukturbiologie von Infektion und Entzündung der Universitäten Hamburg und Lübeck. Manche Biomoleküle bilden allenfalls Mikrokristalle, die sich bislang nur mit dem hochintensiven Licht von Röntgenlasern analysieren lassen. Röntgenlaser wie der European XFEL, der zurzeit von DESY in Hamburg bis nach Schenefeld in Schleswig-Holstein gebaut wird, sind große Anlagen, von denen weltweit erst zwei in Betrieb sind.
Das Team hat nun an DESYs Röntgenquelle PETRA III einen Weg gefunden, wie sich Mikrokristalle auch mit häufiger verfügbaren Forschungslichtquellen, sogenannten Synchrotronstrahlungsquellen, untersuchen lassen. Sie züchteten dazu Mikrokristalle aus dem Enzym Cathepsin B des Parasiten Trypanosoma brucei, der die Schlafkrankheit auslöst. Die nadelförmigen Kristalle waren typischerweise 4 bis 15 tausendstel Millimeter (Mikrometer) lang. Die Forscher fischen wie beim Herstellen von Seifenblasen aus einer wässrigen Kristall-Suspension mit einer kleinen Nylonfadenschlinge einen etwa 20 Mikrometer dünnen Film heraus. In dem Film befinden sich jeweils rund 5000 Mikrokristalle.
Die so präparierte Nylonschlinge wird in die Messapparatur eingespannt und mit dem feinen und intensiven Röntgenstrahl von DESYs Synchrotronstrahlungsquelle PETRA III abgerastert. Der Strahl an der Messstation P14, die von EMBL betrieben wird, hat lediglich einen Durchmesser von knapp fünf tausendstel Millimetern und tastet nach und nach alle Kristalle in der Schlinge ab, wobei jeder Bereich der Probe etwa eine halbe Sekunde belichtet werden kann, bevor die intensive Röntgenstrahlung den untersuchten Kristall beschädigt. Auf diese Weise konnten die Forscher bereits aus rund 80 Kristallen die atomgenaue Struktur des Enzyms mit einer räumlichen Auflösung von 0,3 millionstel Millimetern (Nanometern) bestimmen. "Diese Proteinkristalle gehören mit zehn Kubikmikrometern Volumen zu den kleinsten, die bislang mit Synchrotronstrahlung analysiert wurden", betont EMBL-Wissenschaftler Thomas Schneider.
"Unsere Methode ist besonders interessant für sehr schwer zu kristallisierende Moleküle", betont Redecke. "Ein Vorteil des Verfahrens ist, dass wir mit Komponenten arbeiten, die an vielen Forschungslichtquellen vorhanden sind oder in Zukunft vorhanden sein werden", erläutert Gleb Bourenkov vom EMBL, der zweite Erstautor der Studie. Allerdings kann nicht jede Synchrotronstrahlungsquelle diese Analyse leisten. Man benötigt einen besonders feinen Röntgenstrahl von besonders hoher Intensität. Beides kann PETRA III liefern, die gegenwärtig die brillanteste Synchrotron-Röntgenlichtquelle der Welt ist.
Die neue Methode optimiert dabei auch die Ausnutzung des hellen Röntgenlichts. Während für die Standardanalyse größerer Kristalle das helle Röntgenlicht meist gedimmt werden muss, um die empfindlichen Biomoleküle nicht zu schnell zu beschädigen, nutzt das neue Verfahren die maximale Leistung von PETRA III erstmals in der Kristallographie von Biomolekülen aus. "Dieser Ansatz kann Röntgenlaseruntersuchungen bei schwierigen biologischen Proben ergänzen, so dass die Forscher die hochgefragten Anlagen optimal nutzen können", betont CFEL-Forscher Henry Chapman aus dem Team. Da diese Technik auch für andere Forschungslichtquellen interessant ist, haben sich bereits verschiedene Forschungszentren dafür interessiert.