Neue Erkenntnisse über die Bindung von Molekülketten an Oberflächen
Einem internationalen Forschungsteam ist es gelungen, mithilfe der Spitze eines Rasterkraftmikroskops einzelne Molekülketten von einer Goldoberfläche zu entfernen. Dabei konnten sie Kräfte beobachten, mit denen sich die Bindungsenergie von Molekülen bestimmen lässt. Die Resultate des Forschungsteams, an dem Physiker der Universität Basel beteiligt waren, wurden in der Fachzeitschrift PNAS veröffentlicht.
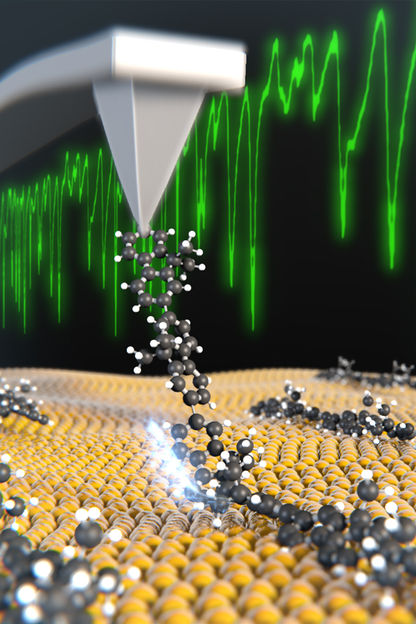
Eine Molekülkette wird mit der Spitze eines Rasterkraftmikroskops von einer Goldoberfläche abgezogen.
Shigeki Kawai
Das Verfahren der Rasterkraftmikroskopie dient normalerweise dazu, die Oberflächentopographie eines Materials in sehr hoher Auflösung abzubilden, indem die Mikroskopspitze rasterförmig über eine Oberfläche fährt. Die Auflösung ist dabei so hoch, dass sich sogar einzelne Atome abbilden lassen. «Das entspricht ungefähr dem Versuch, mit der Spitze des Matterhorns einen Pingpongball abzutasten», sagt Prof. Ernst Meyer vom Departement Physik der Universität Basel. Anhand einer verbesserten Methode können die Forschenden nun sehr präzise Aussagen über den Prozess des Loslösens von Molekülen und die dazu benötigte Kraft treffen.
Mittels der Spitze eines Rasterkraftmikroskops gelang es den Forschenden nämlich, einzelne Molekülketten (Polymere) von einer Goldoberfläche abzulösen. «Die Wechselwirkung zwischen der Oberfläche und den Molekülen ist so schwach, dass sich immer nur ein Kettenglied nach dem anderen ablöst. So lässt sich die Kette fast senkrecht zur Oberfläche abziehen», erklärt Meyer den Vorgang. Die Forschenden beobachteten dabei Schwingungen, mit denen sich quantitative Aussagen über die molekulare Bindungsenergie treffen lassen.
Bewegung ohne Reibung
Ausserdem zeigten die Experimente, dass sich die molekularen Ketten mit sehr geringen Seitwärtskräften abziehen lassen. Dieses Konzept der praktisch reibungsfreien Bewegung wurde bereits zuvor anhand eines theoretischen Modells vorausgesagt und wurde nun für molekulare Ketten auf Goldoberflächen erstmals bestätigt. Bisher konnte das mechanische Verhalten einer einzelnen Molekülkette während des Abziehens von einer Oberfläche noch nie mit atomarer Auflösung abgebildet und vermessen werden. Die Beobachtungen und Rechnungen des Forschungsteams liefern nun erstmals detaillierte Einsichten in diesen Prozess.
Nicht nur für die Physik, sondern auch für die Biologie und Chemie sind solche Untersuchungen von Interesse, denn das Konzept, Molekülketten abzuziehen, ist auch auf biologische Moleküle anwendbar. Bisher hat es wichtige Hinweise auf das Falten und Entfalten von DNS und Proteinen gegeben. Mit der neuen Methode könnten chemische Reaktionen von viel kleineren Einheiten innerhalb von Biomolekülen oder von komplexen Polymerketten unter dem Einfluss von Zugkräften und katalytischen Nanopartikeln untersucht werden.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Shigeki Kawai, Matthias Koch, Enrico Gnecco, Ali Sadeghi, Rémy Pawlak, Thilo Glatzel, Jutta Schwarz, Stefan Goedecker, Stefan Hecht, Alexis Baratoff, Leonhard Grill and Ernst Meyer; Quantifying the atomic-level mechanics of single long physisorbed molecular chains; PNAS Early Edition
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

NANOPHOX CS von Sympatec
Partikelgrößenanalyse im Nanobereich: Hohe Konzentrationen problemlos analysieren
Zuverlässige Ergebnisse ohne aufwändige Probenvorbereitung

DynaPro Plate Reader III von Wyatt Technology
Screening von Biopharmazeutika und anderen Proteinen mit automatisierter dynamischer Lichtstreuung
Hochdurchsatz-DLS/SLS-Messungen von Lead Discovery bis Qualitätskontrolle

Eclipse von Wyatt Technology
FFF-MALS System zur Trennung und Charakterisierung von Makromolekülen und Nanopartikeln
Neuestes FFF-MALS-System entwickelt für höchste Benutzerfreundlichkeit, Robustheit und Datenqualität

Holen Sie sich die Chemie-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Azentrischer_Faktor

Aalberts Surface Treatment GmbH - Kerpen, Deutschland
Schilfrohrplatte
Proteinfasern als alternative Kunststoffe? - Amyloide - nicht nur pathologisch, sondern auch interessante Nanomaterialien

Eine Bremse für kreiselnde Moleküle - Die genaue Kontrolle über die Rotationstemperatur von Molekülionen eröffnet neue Möglichkeiten etwa für die Astrochemie im Labor
Proteine als Medikamente nutzen
Der Physiker Niels Fertig erhält den Nanowissenschaftspreis 2005
Dem Phänomen der Supraleitung auf der Spur - Fermionische Paarbildung bei hohen Temperaturen: Nachweis eines exotischen Materiezustands gelungen
Forscher entdecken neues Teilchen am CERN