Van-der-Waals-Kraft neu vermessen
Physiker weisen nichtlinearen Anstieg mit steigender Molekülgröße nach
Die Van-der-Waals-Kräfte wirken als eine Art Quantenkleber auf alle Arten von Materie ein. Wie stark sie einzelne Moleküle an eine Oberfläche binden, haben Wissenschaftler des Forschungszentrums Jülich mit einem neuen Messverfahren nun erstmals in allen wesentlichen Details experimentell bestimmt. Mit dem Rasterkraftmikroskop konnten sie nachweisen, dass die Kräfte nicht nur mit der Molekülgröße ansteigen, sondern sogar überproportional dazu anwachsen. Die in der Fachzeitschrift Nature Communications erschienenen Ergebnisse können dazu beitragen, grundlegende Simulationsmethoden für die Chemie, Physik, Biologie und Materialwissenschaften zu verbessern.
Schematischer Versuchsaufbau: Beim Ablösen verschiedenartiger Moleküle von der Metalloberfläche ließen sich die Van-der-Waals-Kräfte durch Frequenzänderungen an der Spitze des Rasterkraftmikroskops ermitteln.
Forschungszentrum Jülich
Obwohl vor rund 150 Jahren entdeckt, ist die Van-der-Waals-Kraft nach wie vor nur sehr schwierig zu bestimmen, wenn es um die Vorhersage des Verhaltens von Festkörpern, Flüssigkeiten und Molekülen geht. Präzise Messungen waren bisher nur für einzelne Atome oder makroskopische Objekte möglich. Von besonderer Bedeutung sind die van der Waals Kräfte jedoch gerade im mittleren Größenbereich, wo sie das Verhalten komplexer Moleküle, etwa von Biomolekülen und Proteinen, maßgeblich mitbestimmen. Sie sind auch verantwortlich für die Funktion von bestimmten Klebstoffen und stecken hinter der erstaunlichen Haftkraft von Geckos, die dank dieser Kräfte sogar eine glatte Wand hochgehen können.
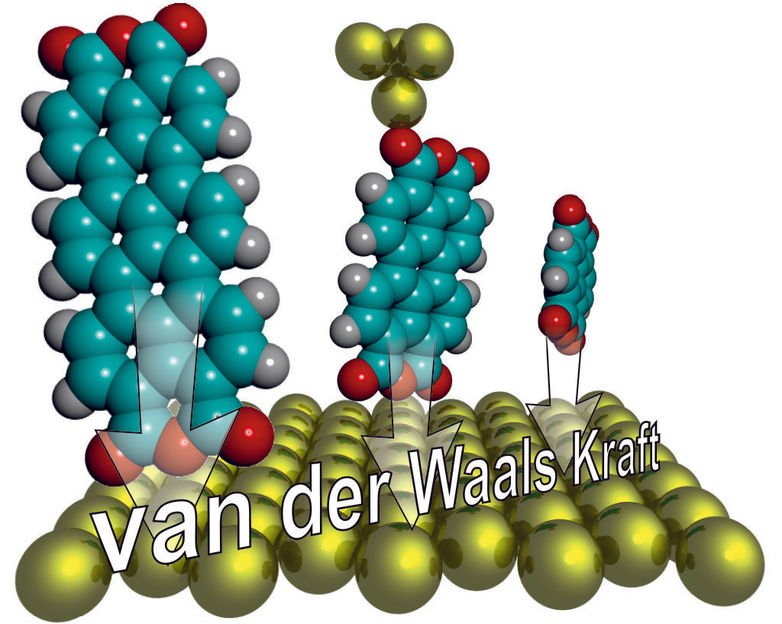
„Mit unserer Methode konnten wir die Van-der-Waals-Kraft für einzelne Moleküle erstmals kontinuierlich über eine größere Distanz bestimmen“, berichtet Dr. Christian Wagner. Die gemessenen Werte stimmen mit theoretischen Vorhersagen überein, denen zufolge die Bindungsstärke mit der dritten Potenz des Abstands abnimmt – was die äußerst geringe Reichweite der Wechselwirkung erklärt. Zudem zeigte sich: Je größer das Molekül, desto stärker ist auch die Anziehung zur Oberfläche. Tatsächlich ist dieser Effekt sogar noch etwas stärker als einfache Modelle nahelegen, und auch, als man intuitiv meinen könnte. „In der Regel wird nur die Wechselwirkung aller beteiligten Atome addiert. Doch die Van-der-Waals-Kräfte, die wir gemessen haben, gehen um etwa zehn Prozent darüber hinaus“, erklärt der Physiker vom Jülicher Peter Grünberg Institut.
Stärkere Bindung durch Bewegungsspielraum
Der Grund für die überproportionale Zunahme: Die Van-der-Waals-Kraft geht, vereinfacht gesagt, darauf zurück, dass sich die Elektronen in der Hülle von Atomen und Molekülen, ausgehend von Quantenfluktuationen, derart verschieben, dass es zu einer schwachen elektrischen Anziehung kommt. Bei größeren Molekülen sind aber nicht nur insgesamt mehr Atome beteiligt, da jedes von ihnen aus mehr Atomen besteht. Auch jedes einzelne Atom leistet einen stärkeren Beitrag.
„Da große organische Moleküle oftmals Elektronenwolken ausbilden, die sich über das gesamte Molekül erstrecken, bieten sie den Elektronen deutlich mehr Bewegungsfreiraum als ein einzelnes Atom“, erklärt der Leiter der Jülicher Nachwuchsgruppe Dr. Ruslan Temirov. „Daher lassen sie sich auch leichter verschieben, was die elektrische Anziehung überproportional erhöht.“
Kraftmessung mit Stimmgabel
Für die Messungen hefteten die Wissenschaftler komplexe organische Kohlenstoffverbindungen, die sie auf einer Metalloberfläche angelagert hatten, an die Spitze eines Rasterkraftmikroskops. Diese hatten sie ihrerseits an einem Schwingungssensor befestigt, sodass sich die Spitze ähnlich wie eine winzige Stimmgabel sehr schnell hin und her bewegt. Beim Ablösen der Moleküle von der Oberfläche verändert sich diese Schwingungsfrequenz und lässt Rückschlüsse auf die van-der-Waals-Kräfte zu, auch dann, wenn sich die Spitze bereits einige Moleküllängen (ca. 4 Nanometer) von der Oberfläche entfernt hat.
Die ermittelten Werte sind insbesondere für Simulationsrechnungen mittels Dichtefunktionaltheorie interessant, deren Entwicklung 1998 mit dem Nobelpreis gewürdigt wurde. Das Verfahren ist die heute am häufigsten verwendete Methode zur Berechnung von strukturellen, elektronischen und optischen Eigenschaften von Molekülen und Festkörpern, hat aber trotz vieler Vorteile immer noch Probleme, die Van-der-Waals-Kräfte korrekt vorherzusagen.
Originalveröffentlichung
Non-additivity of molecule-surface van der Waals potentials from force measurements; C. Wagner et al.; Nat. Commun. (published online 26 November 2014)





























































