Van-der-Waals-Kraft haftet besser als gedacht
Die quantenmechanische Beschreibung der Kraft bewährt sich an realen Strukturen
Sie sorgen dafür, dass Gase unterhalb einer bestimmten Temperatur zu Flüssigkeiten kondensieren. Sie geben Klebstoff ihre Haftkraft und lassen einen Gecko kopfüber an einer Wand hängen: die Van-der-Waals-Kräfte. Mit einem quantenmechanischen Ansatz ist es Forschern des Berliner Fritz-Haber-Instituts der Max-Planck-Gesellschaft gemeinsam mit Kollegen in Italien und den USA gelungen, die Anziehungskräfte, die zwischen ungeladenen Nanostrukturen wirken, akkurater zu beschreiben, als das bislang möglich war. Erstmals wendeten sie das Konzept dabei erfolgreich auf reale Molekülstrukturen an. Die Forscher können sich vorstellen, dass eines Tages auch praxisorientierte Materialwissenschaftler, Prozessdesigner oder auch Wirkstoffforscher vom besseren Verständnis der Van-der-Waals-Kräfte profitieren werden. Zum Beispiel, weil es so möglich werden könnte, die Kräfte gezielt zu modulieren.
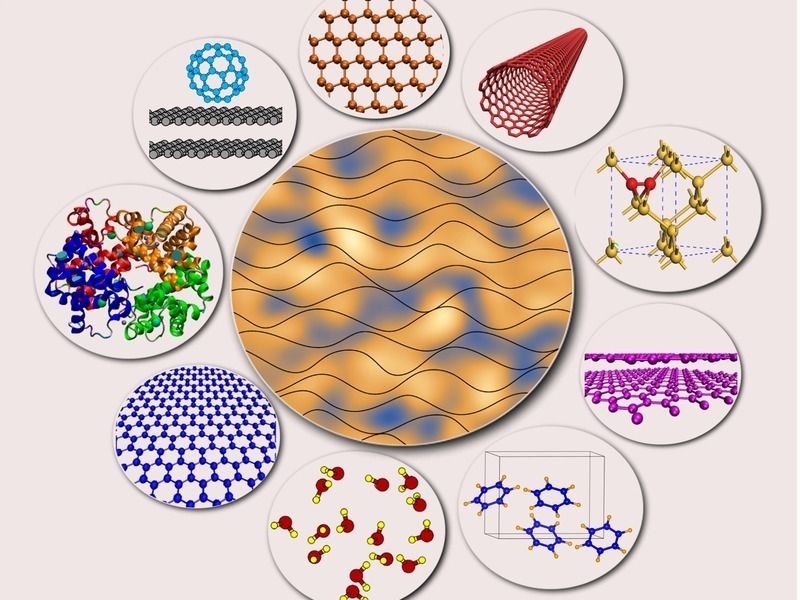
Weil sie die Van-der-Waals-Kraft als Wechselwirkung nicht zwischen Teilchen, sondern zwischen Wellen beschreiben, haben Forscher unter anderem des Fritz-Haber-Instituts festgestellt, dass die Anziehungskräfte zwischen ungeladenen Atomen und Molekülen deutlich weiter reichen als bislang angenommen. Damit verändert sich das Verständnis der Kräfte, die zwischen Nanostrukturen wie einzelnen Graphenblättern, Proteinen und Kohlenstoffnanoröhrchen wirken.
Fritz-Haber-Institut der MPG, University of Luxembourg
Die Anziehungskräfte zwischen Atomen oder Molekülen, die der niederländische Physiker Johannes Diderik van der Waals vor beinahe 150 Jahren entdeckte, sind zwar viel schwächer als die Kräfte zwischen Ionen oder zwischen zwei Atomen, die durch eine echte chemische Bindung verknüpft sind. Dennoch haben sie große Wirkung. Und das nicht nur weil sie die Teilchen in Flüssigkeiten zusammenhalten. In der Biochemie erweisen sie sich geradezu als lebenswichtig, bestimmen sie doch, wie Enzyme mit anderen Biomolekülen interagieren. Die Bedeutung der Van-der-Waals-Kräfte dürfte mit den Fortschritten in der Nanotechnik zudem noch wachsen. Schließlich sind sie die beherrschenden Kräfte zwischen ungeladenen Nanostrukturen und entscheiden letztlich auch darüber, welche Dienste Nanostrukturen leisten können.
Ihrem Ursprung nach sind Van-der-Waals-Kräfte elektrostatische Kräfte. Sie wirken nicht nur zwischen polaren Molekülen, sondern auch zwischen elektrisch neutralen Atomen und Molekülen. Das liegt daran, dass die Bewegung der Elektronen in der äußeren Hülle der Atome vorübergehend zu Ladungsverschiebungen führt – und es zu einer sogenannten Polarisierung kommt. Ladungsbereiche mit unterschiedlichem Vorzeichen ziehen sich dann an – und sorgen damit für eine Attraktion zwischen zwei Atomen, auch wenn diese elektrisch insgesamt jeweils neutral sind.
Paradigmenwechsel bei der Beschreibung von Van-der-Waals-Kräften
Obwohl die Kräfte schon so lange bekannt sind, ist ihre physikalische und auch mathematische Beschreibung noch immer unzureichend. Zwar gibt es ein klassisches Modell, das auf den Physiker Fritz London und die 1930er-Jahre zurückgeht. Demnach wirken bei Van-der-Waals-Kräften einzelne Atome paarweise aufeinander ein. Dabei gingen Physiker in der mathematischen Beschreibung der Kräfte davon aus, dass diese mit der siebten Potenz des Abstandes zwischen den Atomen abnehmen. Sie sollten demnach also nur eine Reichweite von bis zu einem Nanometer, einem Milliardstel Meter, besitzen.
Dieser mathematischen Beschreibung widersprechen jedoch Messungen, wie sie Physiker dank heutiger technischer Möglichkeiten inzwischen auch an kleinsten Strukturen vornehmen können. Und dem widersprechen auch die theoretischen Kalkulationen, die jetzt Forscher vom Fritz-Haber-Institut der Max-Planck-Gesellschaft in Berlin gemeinsam mit Kollegen in Italien und den USA durchgeführt haben. Sie legten ihren Berechnungen ein quantenmechanisches Modell zugrunde. „Alle Elektronen bewegen sich um die Atomkerne, und wir beschreiben diese gesamte Bewegung aller Elektronen in einem Molekül oder einer Struktur als Wellenfunktion“, erklärt Alexandre Tkatchenko, Gruppenleiter in der Abteilung Theorie am Berliner Fritz-Haber-Institut und Professor für Physik der kondensierten Materie an der Universität von Luxemburg, das Vorgehen. Der Physiker sieht hier eine Analogie zu den sogenannten Oberflächenplasmonen, also den Schwingungen der äußeren Elektronen auf Metallpartikeln. „Wenn man zwei Moleküle oder Nanostrukturen einander nähert, dann interagieren die Wellen, also die jeweiligen Elektronenschwingungen, miteinander“, so Tkatchenko. Das Resultat dieser Wechselwirkung sei gerade die Van-der-Waals-Kraft.
Bis zu 100 Nanometer weit wirkt die Anziehung
Unter den gemachten Annahmen war es den Wissenschaftlern dann möglich, den energetischen Zustand zweier benachbarter Moleküle oder auch zweier Nanostrukturen zu berechnen – und damit auch auf die zwischen ihnen jeweils wirkende Kraft zu schließen. Diese Berechnung spielten sie für beliebige Abstände durch. Dabei stellten sie unter anderem fest, dass die Van-der-Waals-Kraft bei zunehmender Entfernung mit deutlich langsamer abnimmt als bislang angenommen. Damit ist ihre Reichweite viel größer als aus dem herkömmlichen Modell zu schließen war. „Bis zu 100 Nanometer weit wirkt diese Anziehung“, so Alexandre Tkatchenko. Eine weitere neue Erkenntnis: Der Grad der Abnahme, also der genannte Exponent, ist keineswegs konstant, sondern variiert seinerseits mit dem Abstand. Tkatchenko spricht von einem Paradigmenwechsel bei der Beschreibung der Van-der-Waals-Wechselwirkung. Und der führt offenbar zu einer guten Wiedergabe der Realität. Die Berechnungen der Wissenschaftler decken sich jedenfalls gut mit experimentellen Befunden anderer Forscher aus der jüngeren Vergangenheit.
Tkatchenko betont, dass das hier zugrunde gelegte Konzept erstmals erfolgreich bei realen Molekülstrukturen angewandt worden sei, mit denen Chemiker oder Biologen täglich arbeiten. Unter anderem hatten die Forscher berechnet, welche Kräfte zwischen zwei ebenen Graphenschichten wirken. Zudem ermittelten die Forscher, wie stark sich Kohlenstoffnanoröhrchen anziehen. In einem Fall berechneten sie auch die Anziehung zwischen einer fiktiven Kette aus Kohlenstoffatomen und einem Eiweiß-Molekül.
Bedeutung für Werkstofftechniker und Wirkstoffentwickler
Van-der-Waals-Kräfte sind zwar rund zehnmal schwächer als etwa die Kraft, die zwischen unterschiedlich geladenen Ionen wirkt. Trotzdem sind sie nicht nur für Theoretiker wie Tkatchenko und sein Team interessant, sondern haben auch für anwendungsbezogene Forscher große Relevanz. Etwa für solche, die an innovativen Klebstoffen forschern. Oder auch für Werkstofftechniker. „Nehmen Sie ein Flugzeug“, sagt Tkatchenko. „Dessen Bauteile basieren heute zunehmend auf Polymer-Materialien. Wie sich die einzelnen Polymer-Moleküle beim Erstarren zueinander anordnen, bestimmen maßgeblich die zwischen ihnen wirkenden Van-der-Waals-Kräfte.“ Diese besser zu verstehen und mit ihnen rechnen zu können, sei damit auch für solche Anwendungsfelder interessant.
Auch für Wirkstoffentwickler etwa in der Pharmaindustrie könne eine bessere Beschreibung von Van-der-Waals-Kräften hilfreich sein. Schließlich sind es vor allem diese Kräfte, die darüber entscheiden, wie gut ein Wirkstoffmolekül an eine Zielstruktur im Organismus, häufig ein Protein, bindet. Nachdem sein Team den neuen Berechnungsansatz erfolgreich auf die Wechselwirkungen realer Moleküle angewendet hat, hofft der Physiker Alexandre Tkatchenko, dass künftig auch Biologen und Chemiker die Vorteile für ihre jeweiligen Arbeitsgebiete erkennen.