Kaltes Wasser: Und es bewegt sich doch!
Neue Form der Chemie möglich
Bei minus 150 Grad Celsius flüssiges Wasser beobachten, das beherrschen Chemiker der Universität Innsbruck. Nun haben sie gemeinsam mit Forschern in Schweden und Deutschland experimentell nachgewiesen, dass zwei unterschiedliche Formen von Wasser existieren, die sich in Struktur und Dichte stark unterscheiden.
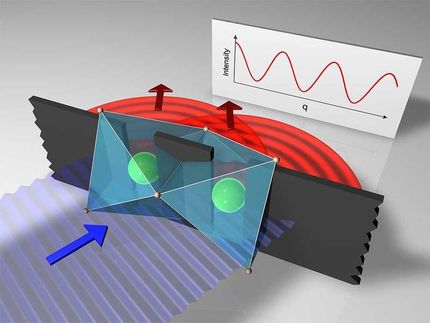
Künstlerische Darstellung der beiden zähflüssigen Formen von Wasser vor einem Röntgenbeugungsbild aus der Studie.
Mattias Karlén
Die Wissenschaft sucht seit langem nach dem Grund, warum ausgerechnet Wasser das Molekül des Lebens ist. Mit ausgefeilten Techniken gelingt es Forschern am Institut für Physikalische Chemie der Universität Innsbruck Wasser bei Temperaturen von rund minus 150 Grad Celsius in zähflüssigem Zustand zu beobachten und dessen Eigenschaften zu untersuchen. Bereits vor vier Jahren hat das Team um Thomas Lörting Hinweise gefunden, dass stark unterkühltes Wasser aus zwei unterschiedlich dichten Formen existiert. „In unserem Experiment zeigte sich damals, dass es abhängig vom Umgebungsdruck zwei unterschiedliche flüssige Formen von Wasser gibt, eine mit niedriger Dichte und eine hochdichte Form.“ Dieser Befund ist überaus erstaunlich, könnte er doch bedeuten, dass auch ganz normales Leitungswasser aus zwei Flüssigkeiten besteht. Untersucht werden kann das Phänomen freilich nur unter extremen Bedingungen, weil die beiden Flüssigkeiten bei sehr tiefen Temperaturen getrennt voneinander existieren.
Wassermoleküle in Bewegung
Nun hat das Team um Thomas Lörting gemeinsam mit Forschern der Universität Stockholm am deutschen Großforschungszentrum DESY in Hamburg stark unterkühltes Wasser mit Hilfe eines stark gebündelten Röntgenstrahls untersucht. Mit Kleinwinkel-Röntgenstreuung lässt sich nämlich die Bewegung von Molekülen in einer Probe bestimmen. „Wir wollten in diesem Experiment sehen, ob die Moleküle wie in Festkörpern an Ort und Stelle gebunden sind, oder ob sie sich wie in einer Flüssigkeit im Raum umherbewegen“, erzählt Thomas Lörting. Die an der Universität Innsbruck erzeugten Proben aus amorphem Eis - also nicht kristallisiertem Eis - wurden am DESY mit Röntgenstrahlen beschossen und so die Bewegung der Wassermoleküle abhängig von der Temperatur bestimmt. Dabei zeigte sich, dass ab circa minus 160 Grad Celsius die Bewegung der Moleküle stark zunimmt. „Aus der Analyse der Daten konnten wir als Bewegungsraum eines Moleküls 50 Nanoquadratmeter pro Sekunde bestimmten, was für ein Molekül eine sehr große Fläche ist“, betont Lörting. Auch nach dem Übergang von hochdichtem in niedrigdichtes Wasser bei circa minus 137 Grad Celsius bewegen sich die Moleküle, allerdings nicht mehr ganz so schnell. Diese Dynamik zeigt, dass die zwei Phasen tatsächlich flüssig sind. „Es ist wie ein wahrgewordener Traum beobachten zu können, wie sich Wasser von einem glasartigen Zustand in eine viskose Flüssigkeit und dann fast sofort in eine weitere, noch zähflüssigere Substanz von sehr viel niedrigerer Dichte verwandelt“, freut sich Katrin Amann-Winkel, ehemaliges Mitglied der Arbeitsgruppe von Thomas Lörting in Innsbruck und nun Forscherin an der Universität Stockholm.
Neue Form der Chemie möglich
In Zukunft wollen die Innsbrucker Wissenschaftler ein Experiment bauen, in dem sie beliebig zwischen den beiden Zuständen hin- und herspringen können. „Dazu müssen wir das System in einen Gleichgewichtszustand bringen, was nur unter hohem Druck möglich ist“, sagt Thomas Lörting. Es gibt bereits Ideen, wie die aktuellen Messungen in einer Hochdruckkammer wiederholt werden können. Die Forscher wollen in den nächsten Jahren aber auch klären, ob Chemie in stark unterkühltem Wasser nur in Zeitlupe abläuft, oder ob dieses Tieftemperatur-Lösungsmittel das Tor zu einer ganz neuen Form von Chemie aufstößt.
Originalveröffentlichung
"Diffusive dynamics during the high-to-low density transition in amorphous ice"; Fivos Perakis, Katrin Amann-Winkel, Felix Lehmkühler, Michael Sprung, Daniel Mariedahl, Jonas A. Sellberg, Harshad Pathak, Alexander Späh, Filippo Cavalca, Daniel Schlesinger, Alessandro Ricci, Avni Jain, Bernhard Massani, Flora Aubree, Chris J. Benmore, Thomas Loerting, Gerhard Grübel, Lars G. M. Pettersson, and Anders Nilsson; Proc. Natl. Acad. Sci.; 2017
Meistgelesene News
Originalveröffentlichung
"Diffusive dynamics during the high-to-low density transition in amorphous ice"; Fivos Perakis, Katrin Amann-Winkel, Felix Lehmkühler, Michael Sprung, Daniel Mariedahl, Jonas A. Sellberg, Harshad Pathak, Alexander Späh, Filippo Cavalca, Daniel Schlesinger, Alessandro Ricci, Avni Jain, Bernhard Massani, Flora Aubree, Chris J. Benmore, Thomas Loerting, Gerhard Grübel, Lars G. M. Pettersson, and Anders Nilsson; Proc. Natl. Acad. Sci.; 2017
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Chemie-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.