Auf chemischen Wellen zu Katalysatoren der Zukunft
Spektakuläre Elektronenmikroskop-Aufnahmen führen zu wichtigen Erkenntnissen
Spektakuläre Photoemissionselektronenmikroskop-Aufnahmen der TU Wien führen zu wichtigen Erkenntnissen: chemische Reaktionen können in spiralartigen Multifrequenz-Wellen ablaufen und lokale Informationen über Katalysatoren liefern.
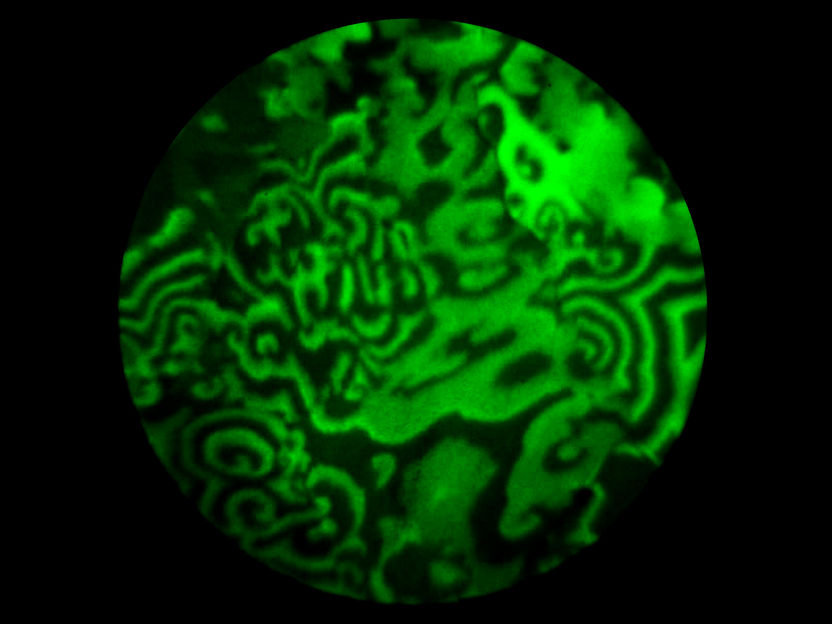
Spiralförmige Wellen bilden sich auf der Rhodium-Folie. Sie liefern wichtige Information über die chemischen Eigenschaften der Oberfläche.
TU Wien
Sie wirken fast hypnotisch, wie eine Lavalampe. Die Wellen, die an der TU Wien unter dem Photoemissionselektronenmikroskop sichtbar werden, überziehen ein Stück Rhodium-Folie mit bizarren Mustern, die über die Oberfläche schwappen.
Wellen kennt man in ganz unterschiedlichen Formen – als Wasserwellen, Lichtwellen oder Schallwellen. Doch hier handelt es sich um etwas ganz anderes – gewissermaßen um Chemie-Wellen. Auf der Kristalloberfläche läuft eine chemische Reaktion ab, aber sie verläuft nicht nur in eine Richtung, sondern kehrt periodisch zum Ausgangszustand zurück. Je nachdem, in welcher Phase dieser zyklisch ablaufenden Reaktion sich die Kristalloberfläche befindet, erscheint sie im Photoemissionselektronenmikroskop hell oder dunkel. Dadurch entsteht ein wanderndes Wellenmuster. Erstmals gelang es nun, diesen Effekt auf mikroskopisch kleinen Kristallkörnern eines polykristallinen Katalysators abzubilden. Dort ergeben sich faszinierende Spiralstrukturen, aus deren Bewegung man Information über die Eigenschaften der einzelnen Kristallkörner erhalten kann.
Hasen, Füchse und Kristalle
Normalerweise stellt man sich eine chemische Reaktion zielgerichtet vor: Aus bestimmten Ausgangsstoffen werden bestimmte Endprodukte. Doch so einfach muss es nicht sein. „Es kann zu Oszillationen kommen, zum periodischen Wechsel zwischen zwei verschiedenen Zuständen“, erklärt Prof. Günther Rupprechter vom Institut für Materialchemie der TU Wien. Das kennt man aus ganz unterschiedlichen Wissenschaftsbereichen – zum Beispiel von Räuber-Beute-Modellen: Wenn Füchse Hasen fressen, bis irgendwann kaum noch Hasen vorhanden sind, werden die Füchse hungern und ihre Anzahl wird zurückgehen – woraufhin sich die Hasenpopulation erholt. Ähnliche Muster findet man bei Immobilienpreisen, oder eben auch bei chemischen Reaktionen.
Das Team an der TU Wien untersucht Wasserstoffoxidation, die Grundlage jeder Brennstoffzelle. Dazu werden Rhodiumkristalle einer Atmosphäre aus Sauerstoff und Wasserstoff ausgesetzt. Zunächst werden Sauerstoffmoleküle (O2) an der Oberfläche adsorbiert und dabei aufgespalten. Die einzelnen Sauerstoffatome können dann ins Innere des Kristalls wandern und unter der äußersten Rhodium-Lage eine dünne Oxidschicht bilden. Dadurch wird aber die Fähigkeit der Oberfläche verringert, weiteren Sauerstoff zu binden. Stattdessen wird vermehrt Wasserstoff gebunden, der im Rhodium dann mit dem vorher aufgenommenen Sauerstoff zu Wasser reagiert. Das Wasser verlässt die Oberfläche wieder, irgendwann ist die Zahl der Sauerstoffatome wieder auf das ursprünglich niedrige Niveau zurückgekehrt, und der ganze Prozess beginnt von vorne.
Unterschiedliche Winkel – unterschiedliche Frequenz
„Solche oszillierenden Reaktionen hat schon der Nobelpreisträger Gerhard Ertl untersucht“, erzählt Prof. Yuri Suchorski, der Erstautor des Papers, der, wie auch Prof. Rupprechter, im Berliner Institut von Prof. Ertl tätig war, bevor er an die TU Wien wechselte. „Wir sind nun aber einen wichtigen Schritt weitergegangen: Uns ist es gelungen, auf einer polykristallinen Oberfläche zahlreiche Oszillationen unterschiedlicher Frequenz gleichzeitig ablaufen zu lassen.“ Eine polykristalline Oberfläche besteht aus unterschiedlichen Kristallkörnern, deren Kristallgitter in unterschiedlichen Winkeln zur Oberfläche ausgerichtet sind.
Diese Winkel spielen eine entscheidende Rolle: Von der Richtung, in der man einen Kristall schneidet, hängt die geometrische Anordnung der Atome auf seiner Oberfläche ab. Und das legt auch die Geschwindigkeit fest, mit der die chemische Reaktion den Oszillations-Zyklus durchläuft.
Auf einer polykristallinen Oberfläche hat man also unterschiedliche Regionen, auf denen der Kreislaufprozess unterschiedlich schnell abläuft. Und genau dadurch ergeben sich faszinierende Wellenmuster: Wenn die Chemie-Welle über die Oberfläche schwappt und dabei die Grenze von einem Kristallkorn zum anderen passiert, wird sie schneller oder langsamer, ähnlich wie Licht, das von der Luft ins Wasser fällt. Dadurch werden die komplizierten spiralförmige Wellenstrukturen entsprechend der Oberfläche des Kristallkorns verändert. „Aus diesen Strukturen können wir nun sehr viel über das Material lernen“, sagt Günther Rupprechter. „Mit einem Blick können wir nun sehen, welche Regionen unserer Oberfläche bessere katalytische Eigenschaften haben.“
Auf dem Weg zur künftigen Wasserstoffenergetik
Wichtig ist das, um mehr über die Katalyse der Wasserstoff-Oxidation zu lernen. „Für die mobilen Energielieferanten der Zukunft, Brennstoffzellen, deren einziges Abgas aus reinem Wasser besteht, braucht man neue Materialien, die beim Spalten von Wasserstoff helfen – doch nach wie vor hat man diese Prozesse nach wie vor nicht völlig verstanden“, sagt Prof. Yuri Suchorski. „Hier sind noch viele Fragen offen – und wir haben jetzt eine neue, sehr elegante Möglichkeit, diesen Fragen nachzugehen.“