Dreiecksbeziehung im Reich der Moleküle
Die so genannten N-Heterocyclischen Carbene (NHC) sind sehr wirksame Katalysatoren. Auf welche Weise sie reagieren, ist aber noch nicht vollständig verstanden. Wissenschaftler der Universität Bonn haben nun das Verhalten gelöster Carbene am Computer simuliert. Dabei wiesen sie eine ungewöhnliche Dreiecksbeziehung nach, die bei manchen der Reaktionen als Zwischenprodukt auftritt. Die Resultate könnten helfen, die Effizienz der katalysierten Reaktionen weiter zu verbessern.
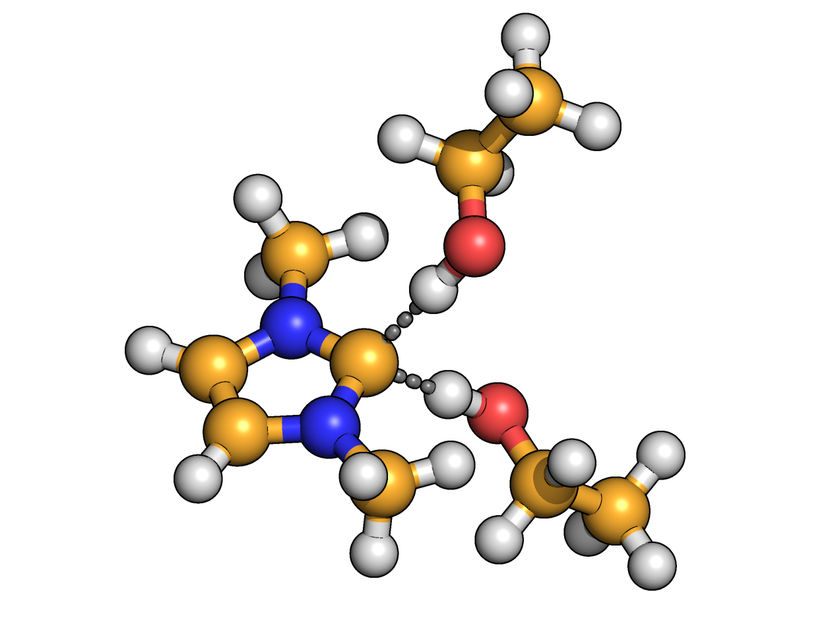
Das Kohlenstoff-Atom des Carbens (gelb) bildet gleichzeitig Wasserstoffbrücken (gestrichelt dargestellt) zu zwei Molekülen aus.
© Sascha Gehrke und Oldamur Hollóczki/Uni Bonn
Carbene sind hoch reaktive Verbindungen. Das liegt an einem ihrer Bausteine – einem Kohlenstoff-Atom. Kohlenstoff verfügt über vier so genannte „freie“ Elektronen. Mit ihnen kann er normalerweise vier Bindungen zu anderen Atomen eingehen. In Carbenen bleibt diese Kontaktfreudigkeit jedoch teilweise ungenutzt: Nur zwei der Elektronen sind an Bindungen beteiligt. Übrig bleibt ein einsames Pärchen, das sich gerne einen Reaktionspartner schnappt, wenn sich die Gelegenheit bietet.
Das Problem dabei: Carbene wirken auf viele Lösungsmittel sehr attraktiv. Ihr einsames Elektronenpaar sorgt nämlich dafür, dass sie lokal negativ geladen sind. Lösungsmittel wie Wasser oder Alkohol enthalten dagegen Wasserstoff, der lokal positiv geladen ist. Aufgrund der elektrostatischen Wechselwirkung fühlt sich dieser zu den Kohlenstoff-Elektronen magisch hingezogen. Das Lösungsmittel-Molekül und das Carben kleben daher aneinander wie zwei Magnete.
Bedrängt wie ein Spitzenfußballer
„Dieser Mechanismus erschwert es anderen Molekülen, mit dem Carben zu reagieren“, erklärt Dr. Oldamur Hollóczki vom Mulliken-Zentrum für Theoretische Chemie der Universität Bonn. Man könnte die Situation des Carbens mit der eines Mittelfeldstars vergleichen: Da sich ihm ständig ein gegnerischer Spieler an die Fersen heftet, fehlt ihm der Raum, seine gefürchteten Pässe zu schlagen.
Der Fußballer versucht dann beispielsweise, sich mit ein, zwei Haken von diesem Schatten zu befreien. Ähnlich könnte es auch in der Welt der Moleküle ablaufen: „Möglicherweise wird zunächst die Wasserstoffbrücke zwischen Carben und Lösungsmittel gebrochen, so dass genug Platz für das regierende Molekül entsteht“, sagt Hollóczkis Mitarbeiter Sascha Gehrke. „Wir haben in unserer Simulation aber nun zeigen können, dass es auch einen anderen Weg gibt.“
Manche Carbene bilden nämlich aufgrund ihres chemischen Aufbaus besonders starke Wasserstoffbrücken aus. Diese lassen sich nicht so einfach lösen. In solchen Fällen kann sich aber eine interessante Zwischenstruktur bilden: In dieser nimmt das einsame Elektronenpaar des Kohlenstoffs nicht nur Kontakt zum Lösungsmittel, sondern gleichzeitig auch zum Reaktionspartner auf. Es entstehen also zwei Wasserstoffbrücken, die beide vom Kohlenstoff des Carbens ausgehen.
Ergebnisse ermöglichen verbesserte Katalyse
Dieses Ergebnis ist auch deshalb interessant, weil es neue Möglichkeiten bietet, die katalysierte Reaktion zu beeinflussen. So sind manche Lösungsmittel einfach zu sperrig, als dass sich diese Dreiecksbeziehung ausbilden könnte. In ihnen läuft die Reaktion daher weit langsamer oder gar nur unter Wärmezufuhr statt. Umgekehrt lassen sich die Erkenntnisse nutzen, um die Katalyse auch bei niedrigen Temperaturen stattfinden zu lassen. Die Synthese würde dadurch nachhaltiger werden. „Da Carbene in vielen Gebieten der organischen Synthese eine wichtige Rolle spielen, etwa auch in der Pharma-Industrie, ist dieser Punkt natürlich von immenser Bedeutung“, betont Hollóczki.
Bislang existiert die ungewöhnliche Dreiecks-Struktur nur als Ergebnis einer Moleküldynamik-Software. Die Wissenschaftler planen nun jedoch, sie tatsächlich herzustellen und genau zu charakterisieren.































































