Wenn Elektronen mittanzen dürfen
Forscher zeigen Möglichkeiten polarisierbarer Simulationen bei ionischen Flüssigkeiten auf
ionische Flüssigkeiten haben besondere Eigenschaften, die sie für viele Anwendungen interessant machen. Je nach Kombination von Anionen und Kationen können die flüssigen Salze z.B. sehr wasser(un)löslich, leitfähig oder temperaturstabil sein. Polarisierbare molekulardynamische Simulationen sind dabei ein wesentlicher Schlüssel, um ionische Flüssigkeiten und ihr Verhalten besser zu verstehen. Ein internationales Forschungsteam um Christian Schröder von der Fakultät für Chemie der Universität Wien präsentiert in einem Überblicksartikel in "Chemical Reviews" den Nutzen bestehender polarisierbarer Modelle für die Untersuchung flüssiger Salze.
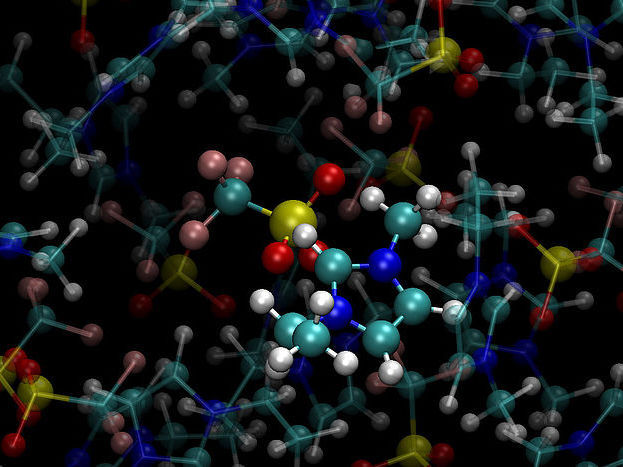
Ausschnitt aus einer MD-Simulation von ionischen Flüssigkeiten.
© Universität Wien
Während klassisches Kochsalz bei etwa 800 Grad Celsius schmilzt, sind ionische Flüssigkeiten bereits bei Raumtemperatur flüssig. Da die vielversprechenden, relativ viskosen Salze kaum entflammbar sind, gelten sie als großer Hoffnungsträger für künftige, unbrennbare Akkus. Als Lösungsmittel können die Salze helfen, Cellulose aufzulösen, Chemikalien wie etwa Koffein aus gebrauchten Kaffeekapseln zurückzugewinnen und andere Verbindungen wie Metalle oder Proteine aus Materialien herauszulösen.
Je nach Anwendung braucht es eine kluge Kombination der Kationen und Anionen, aus denen Salze bestehen. "Es gibt mehrere, unterschiedliche Klassen von Kationen und Anionen, aus denen man ionischen Flüssigkeiten synthetisieren kann", sagt Christian Schröder vom Institut für Computergestützte Biologische Chemie. Da auch Mischungen von ionischen Flüssigkeiten mit anderen (ionischen) Flüssigkeiten interessante Eigenschaften haben, gibt es zu viele Möglichkeiten, um alle im Labor zu testen. "Molekulardynamische Simulationen liefern wichtigen Input zur Interpretation der experimentellen Ergebnisse und helfen bei der Auswahl der optimalen Kationen und Anionen", so Schröder.
Moleküle tanzen lassen
"Bei der molekulardynamischen Simulation (MD) sind die Atome quasi weiche Billardkugeln, die über elastische Kräfte miteinander verbunden sind", erläutert der theoretische Chemiker: "Die Billardkugeln schwingen innerhalb der Moleküle. Die Moleküle drehen sich und bewegen sich in der Lösung gemäß den klassischen Newtonschen Gesetzen. Dabei tanzen sie im (Ionen-)Paar oder trennen sich nach einiger Zeit, um sich neue Tanzpartner zu suchen."
Prinzipiell wäre die Quantenmechanik geeignet, die Wechselwirkung zwischen den Ionen zu bestimmen. Da aber so viele Kationen und Anionen zur korrekten Beschreibung der Lösung notwendig sind, übersteigt dies die heutige Rechenkapazität. MD-Simulationen sind für diese Systeme geeigneter, da man in der Regel von einer konstanten Elektronenverteilung im Molekül ausgeht und so Rechenzeit spart.
"Bei ionischen Flüssigkeiten ist das nicht möglich: Die Kationen und Anionen der Salze ändern ihre Polarisierung, wenn andere Kationen oder Anionen in die Nähe kommen", so Schröder: "Die Elektronen wollen mittanzen." Diese "elektronischen Freiheitsgrade" müsse man für aussagekräftige Ergebnisse in den Simulationsmodellen berücksichtigen.
Polarisierbarkeit inkludiert
In ihrem Überblicksartikel beleuchten Schröder und seine Kollegen Wege der polarisierbaren MD-Simulation: "Wir können mit leicht höherem Rechenaufwand inkludieren, wie die Elektronenwolken der Atome auf ihre umgebenden Moleküle und Ionen reagieren." Die Forscher um Christian Schröder kommen in ihrem Artikel zum dem Schluss, dass zwei Ansätze der polarisierbaren MD-Simulation für ionische Flüssigkeiten geeignet sind: ein physikalischer sowie ein mathematischer Ansatz. In beiden Fällen wird jedem polarisierbaren Atom ein induzierter Dipol angehängt, der die Verzerrung der Elektronendichte je nach Umgebung beschreibt.
"Man kann ohne die Polarisierbarkeit zwar strukturelle Eigenschaften der flüssigen Salze in Simulationen bestimmen, aber keine dynamischen wie etwa die elektrische Leitfähigkeit", sagt der korrespondierende Studienautor. Trotz intensiver Forschung gebe es z.B. noch einige Probleme, geeignete ionische Flüssigkeiten für Akkus zu entwickeln. Bisher designten die Forscher flüssige Salze eher auf Grundlage ihrer Erfahrung: "Aber es fehlt noch das fundamentale Verständnis, warum es in dem einen Fall funktioniert und mit einer anderen Kationen- und Anionen-Kombination nicht."