Anfängliche Abstoßung schließt spätere Anziehung nicht aus
Erstmals Übergang von der Physisorption in die Chemisorption direkt gemessen
Der Philosoph Arthur Schopenhauer hat mit seiner Stachelschwein-Allegorie ein Gleichnis entwickelt, welches einen gewissen Wohlfühlabstand zwischen Menschen erklärt. Demnach fühlen sich Menschen bei zu großem Abstand allein und bei zu kleinem Abstand unwohl aufgrund abstoßender Charaktereigenschaften. Den optimalen Abstand hat er anhand der Stachelschweine so erklärt: „An einem kalten Tag entwickelt eine Gruppe Stachelschweine ein allen gemeines Wärmebedürfnis. Um es zu befriedigen, suchen sie die gegenseitige Nähe. Doch je näher sie aneinanderrücken, desto stärker schmerzen die Stacheln der Nachbarn. Da aber das Auseinanderrücken wieder mit Frieren verbunden ist, verändern sie ihren Abstand, bis sie die erträglichste Entfernung gefunden haben.“
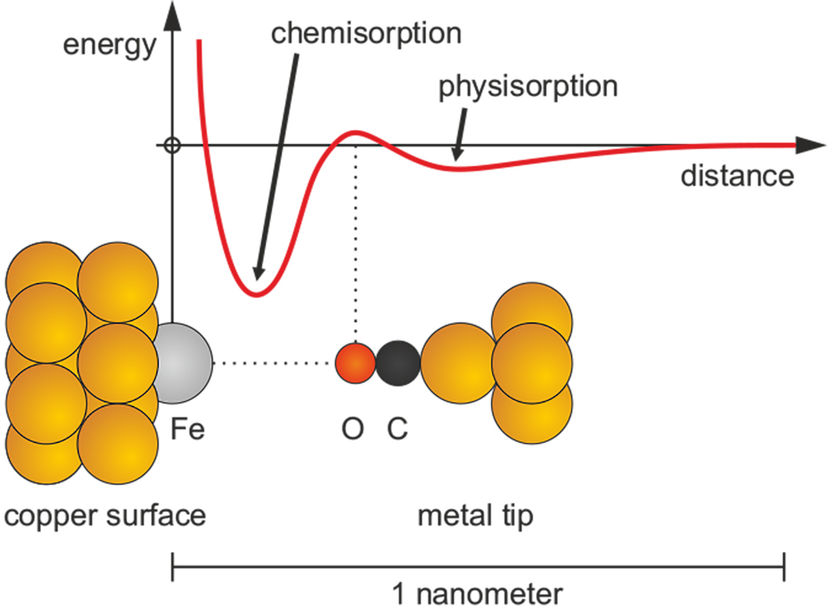
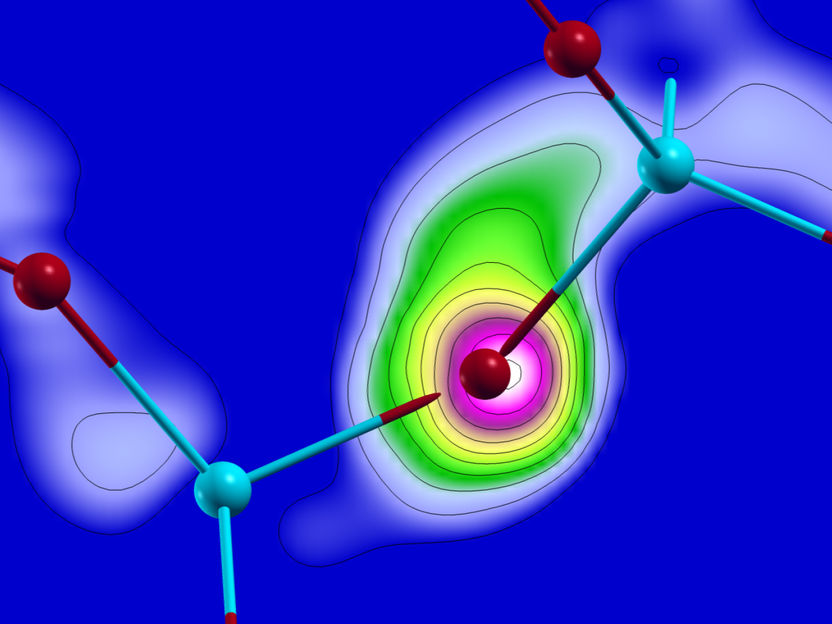
Übergang von einer schwachen Bindung (Physisorption) in eine starke Bindung (Chemisorption)
© Dr. Ferdinand Huber
Der Physiker und Nobelpreisträger Richard Feynman beschreibt in seinem weit verbreiteten dreibändigen Lehrbuch „The Feynman Lectures on Physics“ gleich im ersten Kapitel ein ähnliches Phänomen beim Verhalten der elementaren Bausteine der Materie, den Atomen. Feynman stellt fest, dass im Falle einer weltumspannenden Katastrophe, die das ganze Wissen der Menschheit vernichten würde, ein bestimmter Satz die wertvollste Information in den wenigsten Worten enthalten würde. Dieser Satz lautet: „… alle Dinge bestehen aus Atomen - kleine Teilchen die ständig in Bewegung sind, sich anziehen, wenn sie etwas entfernt sind voneinander, sich aber abstoßen, wenn man sie aufeinander drückt“.
Für die Natur der Atombindungen hat der Physiker Lenard-Jones bereits 1932 eine wichtige Komplikation festgestellt. Es können nämlich auch zwei Bindungstypen mit verschiedenen Gleichgewichtsabständen existieren: eine schwache Bindung, genannt Physisorption und eine starke chemische Bindung, genannt Chemisorption. Erstere ist zum Beispiel für die Anhaftung von Staub auf Oberflächen oder von Geckos auf Wänden verantwortlich. Die Zweitere ist zehn bis hundert Mal stärker als die Physisorption. Das Wechselspiel dieser Adsorptionsarten ist wichtig für den Ablauf chemischer Reaktionen auf Oberflächen, zum Beispiel bei der Abgasreinigung im Autokatalysator oder bei der katalytischen Gewinnung chemischer Grundstoffe. Die Existenz dieser beiden Adsorptionsarten wird durch eine Energiekurve mit zwei Minima dargestellt. Derartige Graphiken werden seit Jahrzehnten in den Lehrbüchern der physikalischen Chemie und Oberflächenphysik abgedruckt, obwohl sie bisher nur theoretisch postuliert waren.
Einer Gruppe experimenteller Physiker von der Universität Regensburg (Dr. Ferdinand Huber, Julian Berwanger, Prof. Dr. Franz J. Giessibl) ist es erstmals gelungen, den Übergang von der Physisorption in die Chemisorption direkt zu messen, indem sie ein Kohlenstoffmonoxid-Molekül an der Spitze ihres Rasterkraftmikroskops befestigten, dieses an ein einzelnes Eisenatom auf einer Kupferoberfläche annäherten und die Kraftentwicklung bei der Annäherung aufzeichneten. Unterstützt wurden sie von einem Team von Quantenchemikern (Svitlana Polyesa, Dr. Sergiy Mankovsky, Prof. Dr. Hubert Ebert) der Ludwig-Maximilians-Universität München, welche die theoretische Erklärung beisteuerten. Die Überwindung der Potentialbarriere nach der Physisorption erfordert eine sogenannte Hybridisierung, die in den quantenchemischen Rechnungen erklärt und nachgewiesen wurde.
Zurückkommend auf Schopenhauer und menschliche Beziehungen soll es dort beobachtet worden sein, dass anfängliche Abstoßung in eine innige Beziehung münden kann.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Chemie-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Laserpuls macht Glas zum Metall
Regenerierbare Langzeitaktivierung auf transparenten Kunststoffen
Tiefe Temperaturen verstärken Ozonabbau über der Arktis - Klimaforscher des KIT untersuchten Entstehung des Ozonlochs
Messverfahren zur Konzentrationsbestimmung im Staubniederschlag