Wasser ist Gold wert für die Nanokatalyse
Einige Katalysatoren zeigen eine erstaunlich hohe Aktivität – deutlich begünstigt durch Wasser
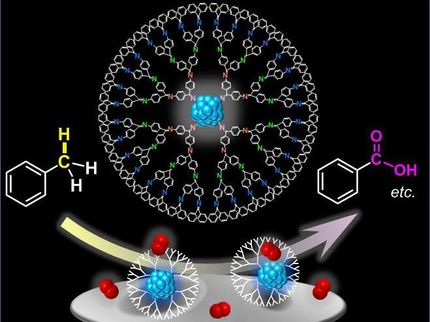
Winzige Goldpartikel, die auf Metalloxide aufgebracht werden, könnten als Nanokatalysatoren für die chemische Industrie dienen – zum Beispiel für die Umwandlung von Alkoholen mittels Oxidation in wertvolle Chemikalien. Die Gold-Metalloxid-Verbindungen zeigen eine hohe katalytische Aktivität, vor allem, wenn sie in wässrigen Lösungen vorliegen. Ein Forschungsteam der Ruhr-Universität Bochum (RUB) hat nun eine Erklärung dafür gefunden: Die Wassermoleküle helfen aktiv bei der Spaltung von Sauerstoff mit, welche für die Oxidationsreaktion erforderlich ist. Das Team um Prof. Dr. Dominik Marx vom Lehrstuhl für Theoretische Chemie berichtet die Ergebnisse in der Zeitschrift „ACS Catalysis“, online veröffentlicht am 14. Juli 2020.

Wasser ist Gold wert (Symbolbild)
No-longer-here, pixabay.com
Wasser reduziert Energiebarriere
In vielen industriellen Oxidationsprozessen kommen Substanzen wie Chlor oder organische Peroxide zum Einsatz, wodurch im Prozess giftige oder unnütze Nebenprodukte entstehen. Eine umweltfreundlichere und wirtschaftlichere Methode wäre es, molekularen Sauerstoff (O2) zu nutzen, zu spalten und die Sauerstoffatome in der Reaktion zu verwenden. Gold-Metalloxid-Verbindungen (Au/TiO2) könnten sich als Katalysatoren für die Spaltung von Sauerstoff eignen. Das Metalloxid, genauer gesagt Titanoxid, dient dabei als Träger für die Gold-Nanopartikel, welche unter anderem die selektive Oxidation von molekularem Wasserstoff, Kohlenstoffmonoxid und Alkoholen katalysieren können. Entscheidend für all diese Umwandlungsprozesse ist die Spaltung von O2. Dafür muss eine Energiebarriere überwunden werden, wobei die Katalysatoren helfen können. Da diese Reaktionen in Wasser ablaufen, ist der Einfluss des Wassers hierbei von großer Bedeutung.
Bereits 2018 hatte das Team von Dominik Marx, Forschungsbereichskoordinator im Exzellenzcluster Ruhr Explores Solvation (Resolv), Hinweise darauf gefunden, dass Wassermoleküle aktiv an der Sauerstoffspaltung beteiligt sein könnten. Nun zeigte das Team, dass Lösungsprozesse den molekularen Sauerstoff an der Oberfläche des Nanokatalysators zusätzlich aktivieren. Die Wassermoleküle helfen somit, die Energiebarriere für die Sauerstoffspaltung zu reduzieren. Die Forscher berechneten, dass der Energiebedarf für die Reaktion in wässriger Lösung 25 Prozent geringer ist als in der Gasphase. „Erstmals haben wir quantitative Einblicke bekommen, wie entscheidend Wasser für die Sauerstoffaktvierung für diesen Nanokatalysator ist – und wir verstehen sogar warum“, sagt Dominik Marx.
Simulationen berücksichtigen Einfluss des Wassers
Die RUB-Forscher nutzten Computersimulationen, sogenannte Ab-initio-Molekulardynamik-Simulationen, in denen sie nicht nur den Katalysator berücksichtigten, sondern auch 80 umgebende Wassermoleküle. Das war entscheidend, um die Unterschiede zwischen Flüssig- und Gasphase verstehen zu können. „Frühere Simulationen haben die Situation sehr vereinfacht betrachtet“, erklärt Dr. Niklas Siemer, der zu diesem Thema an der RUB promovierte. „Sie wurden der wahren Komplexität des Lösungsmittels Wasser nicht gerecht.“
Das Team simulierte das freie Energieprofil des Sauerstoffs in der Flüssig- und Gasphase bei hoher Temperatur und hohem Druck. So konnten sie den Grund für die Solvatationseffekte ermitteln: Die Wassermoleküle verschieben Elektronenladung in Richtung des Sauerstoffs der am Nanokatalysator angedockt ist. Das verringert den Energiebedarf für die Spaltung. „Es hängt alles an den einzigartigen Eigenschaften des Wassers. Wir haben festgestellt, dass die Polarisierbarkeit des Wassers und seine Fähigkeit, Wasserstoffbrückenbindungen einzugehen, hinter der Sauerstoffaktivierung stehen”, sagt Dr. Daniel Munoz-Santiburcio, einer der Autoren. Nach Meinung des Forscherteams könnte die neue Simulationsstrategie helfen, die Oxidationskatalyse detailliert zu verstehen und zu verbessern.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Chemie-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.