Warum verhalten sich Metalloxid-Oberflächen chemisch unterschiedlich?
Neue Untersuchungsmethode beantwortet wichtige Fragen
Metalloberflächen spielen als Katalysatoren für viele wichtige Anwendungen eine Rolle – von der Brennstoffzelle bis hin zur Reinigung von Auto-Abgasen. Ihr Verhalten wird allerdings ganz entscheidend von Sauerstoffatomen bestimmt, die sich an der Oberfläche festsetzen.
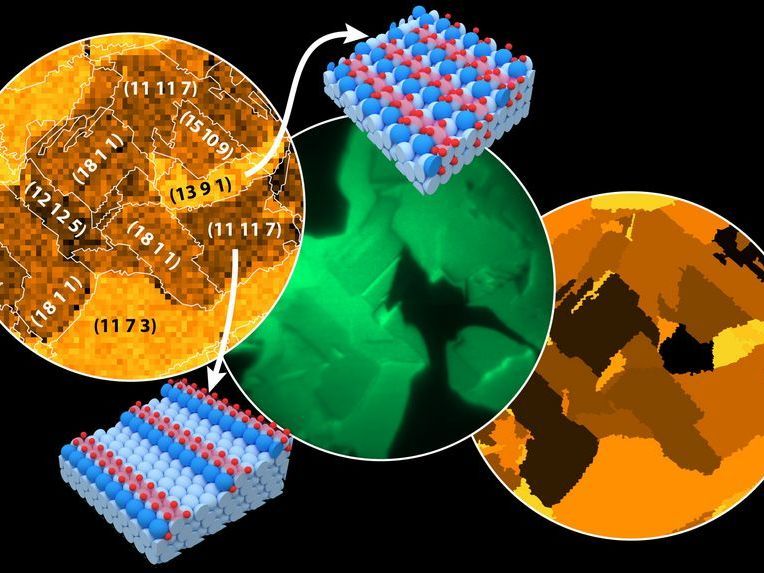
Landkarte der Rhodiumoxidation, erstellt mit Hilfe eines Rasterphotoelektronenmikroskops (engl. SPEM, links); in situ Photoemissionselektronenmikroskop- (engl. PEEM, Mitte) Aufnahme der katalytischen H2 Oxidation an Rh; Landkarte der lokalen katalytischen Aktivität. Sichtfeld 500 µm. Kugelmodelle: Terrassen- (hellblau) und Stufen- (blau) Rh-Atome, oxidierte Rh-Atome (hellrot), O-Atome (rot).
Technische Universität Wien
Das Phänomen kennt man schon lange, aber bisher war es nicht möglich, den Einfluss des Sauerstoffs in komplexen Oberflächen Punkt für Punkt genau zu untersuchen, um die chemischen Hintergründe auf atomarer Ebene zu verstehen. An der TU Wien gelang das nun, in Kooperation mit einem Team des Elettra Synchrotrons in Triest. Dadurch konnte man nun erklären, warum man in vergangenen Studien teilweise widersprüchliche Ergebnisse erhalten hatte: Die Sauerstoffatome verteilen sich nicht gleichmäßig, sondern setzen sich an ganz bestimmten Stellen besonders leicht fest.
Präzisionsmessungen statt Durchschnittswerte
„Eine Metalloberfläche direkt während der Katalyse zu untersuchen, ist eine große Herausforderung“, sagt Prof. Günther Rupprechter vom Institut für Materialchemie der TU Wien, öffnet eine externe URL in einem neuen Fenster. „Man kann natürlich den ganzen Katalysator in einen Reaktor geben und genau messen, welche chemischen Produkte dabei entstehen – doch dabei bekommt man immer nur einen Mittelwert. Man kann nicht wissen, welche Stellen am Katalysator auf welche Weise zur chemischen Reaktion beigetragen haben.“
Eine andere Möglichkeit ist, keinen realen Katalysator zu verwenden, sondern ein einfaches, höchst sauberes, idealisiertes Stück davon – etwa einen winzigen Einkristall, mit exakt bekannten Eigenschaften, den man dann unter dem Mikroskop studieren kann. In diesem Fall erhält man zwar präzise, reproduzierbare Ergebnisse, sie haben mit der praktischen Anwendung aber nicht mehr viel zu tun.
Die Forschungsgruppe um Günther Rupprechter und Yuri Suchorski wollte daher das Beste aus beiden Ansätzen verbinden. Man verwendet dünne Folien aus Rhodium, die aus kleinen Körnchen bestehen. Auf jedem Körnchen können die Oberflächenatome unterschiedlich angeordnet sein. Im einen Körnchen bilden sie eine glatte, regelmäßige Oberfläche, bei der sich die äußeren Atome alle exakt in derselben Ebene befinden, daneben ordnen sich die Atome vielleicht so, dass eine kompliziertere Anordnung entsteht, die aus vielen atomaren Stufen besteht.
Die Lieblingsplätze des Sauerstoffs
Genau diese Stufen stellen sich als entscheidend heraus. „Für die katalytische Aktivität spielt der Oxidationszustand des Katalysators eine zentrale Rolle – also ob sich Sauerstoff an den Metallatomen festsetzt oder nicht“, erklärt Philipp Winkler, der Erstautor der Studie. Bei früheren Experimenten stellte man fest, dass man es oft mit einem Zustand zwischen „oxidiert“ und „nicht oxidiert“ zu tun hatte – ein schwer zu interpretierendes Ergebnis.
Verständlich wird das aber, wenn man feststellt, dass nicht jedes Körnchen der Rhodium-Folie in gleichem Maß oxidiert wird. Die Oxidation beginnt dort, wo es Ecken, Kanten und Stufen gibt – dort fällt es den Sauerstoffatomen besonders leicht, sich an die Oberfläche zu binden. Daher werden unterschiedliche Körnchen mit unterschiedlicher Oberflächenstruktur unterschiedlich stark oxidiert.
Elektronenmikroskop und Synchrotron in Triest
Feststellen konnte man das mit einer Kombination hochentwickelter Technologien: „In einem speziellen Elektronenmikroskop wird die Probe während der chemischen Reaktion mit UV-Licht bestrahlt und die dabei entstehende Elektronenemission wird ortsäufgelöst mikrometergenau gemessen“, erklärt Yuri Suchorski, „dadurch kann man genau feststellen, welche Körnchen der Folie katalytisch besonders aktiv sind. Dieselbe Probe wird dann mit einem ganz anderen Mikroskop noch einmal untersucht: körnchenweise mit Röntgenstrahlung am Synchrotron, was ganz präzise Auskunft über die Oberflächenoxidation der Probe liefert.“
Wenn man beide Ergebnisse verbindet, kann man genau feststellen, welche Strukturen welches chemische Verhalten zeigen. Der entscheidende Vorteil: Man kann in einem einzigen Experiment die gesamte Folie untersuchen, mit hunderten unterschiedlichen Körnchen. Anstatt winzige Einkristalle getrennt voneinander zu studieren kann man eine einzige Probe verwenden, die mehrere Strukturen beinhaltet, welche unter realen Bedingungen für die Katalyse eingesetzt werden, und dabei Auskunft über die Eigenschaften dieser Strukturen auf einmal erhalten.
„Für die Katalyseforschung ist das ein wichtiger Schritt“, betont Rupprechter. „Wir müssen uns nun nicht mehr damit zufriedengeben, einen Mittelwert zu messen, der die gesamte Probe ungenügend beschreibt, sondern können wirklich im Detail verstehen, welche atomaren Strukturen welche Auswirkungen haben. Damit wird es auch möglich sein, wichtige Katalysatoren, die man in der Energie- und Umwelttechnik für viele Einsatzzwecke benötigt, gezielt zu verbessern.“
































































