Entdeckung der "Knock-on-Chemie" eröffnet neue Horizonte in der Reaktionsdynamik
Neue experimentelle Erkenntnisse stellen 90 Jahre altes theoretisches Modell des Übergangszustands in chemischen Reaktionen in Frage
Die Forschung eines Teams von Chemikern an der Universität Toronto unter der Leitung des Nobelpreisträgers John Polanyi wirft ein neues Licht auf das Verhalten von Molekülen, wenn sie während einer chemischen Reaktion zusammenstoßen und Atome austauschen. Die Entdeckung stellt ein 90 Jahre altes theoretisches Modell über das Verhalten des "Übergangszustands", der bei chemischen Reaktionen zwischen Reagenzien und Produkten liegt, in Frage und eröffnet ein neues Forschungsgebiet.
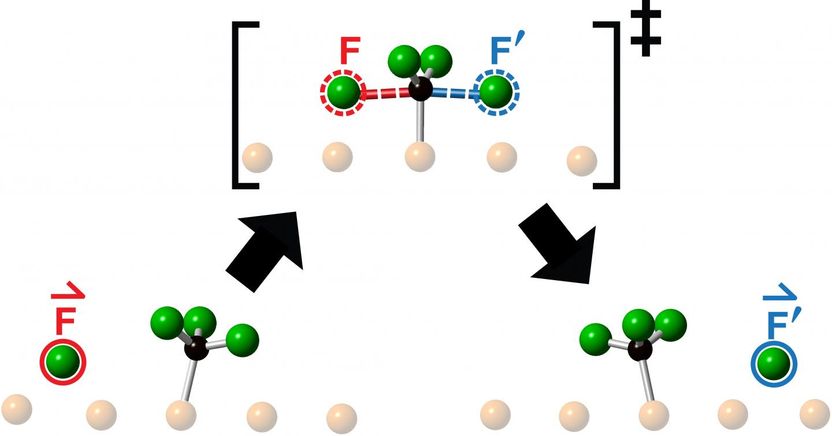
Eine künstlerische Interpretation der Energiebarriere, die ein Reagenz-Fluoratom beim Zusammenstoß mit einem Fluormethylmolekül auf dem Weg zur Bildung eines Produkts als Ergebnis einer chemischen Reaktion überwinden muss. Forscher der Universität Toronto beobachteten den "knock-on" kollinearen Auswurf des Reaktionsprodukts (blau eingekreist) in der Fortsetzung der Richtung des ankommenden Reagenzmoleküls (rot eingekreist).
Illustration: Lydie Leung
Die Forscher untersuchten Kollisionen, die durch den Abschuss eines Fluoratoms auf das Zentrum eines Fluormethylmoleküls - bestehend aus einem Kohlenstoffatom und drei Fluoratomen - erzielt wurden, und beobachteten die resultierende Reaktion mit Hilfe der Rastertunnelmikroskopie. Was sie nach jeder Kollision sahen, war der Auswurf eines neuen Fluoratoms, das sich kollinear entlang der Fortsetzung der Annäherungsrichtung des ankommenden Fluoratoms bewegte.
"Chemiker werfen ständig Moleküle auf andere Moleküle, um zu sehen, was passiert, oder in der Hoffnung, etwas Neues herzustellen", sagt Polanyi, Universitätsprofessor am Department of Chemistry in der Faculty of Arts & Science an der U of T und Seniorautor der Studie, die diesen Monat in Communications Chemistry veröffentlicht wurde ."Wir fanden heraus, dass das Richten eines Reagenzmoleküls auf das Zentrum eines Zielmoleküls die Bewegung des entstehenden Produkts auf eine einzige Linie beschränkt, so als ob das Produkt direkt 'angeklopft' worden wäre. Die überraschende Beobachtung, dass das Reaktionsprodukt in einer geraden Linie austritt, die sich in die gleiche Richtung bewegt wie das ankommende Reagenzatom, legt nahe, dass die Bewegungen, die zur Reaktion führen, einer einfachen Weitergabe von Impuls ähneln.
"Die Erhaltung des linearen Impulses, die wir hier beobachten, deutet eher auf einen kurzlebigen "Übergangszustand" hin als auf die bisherige Ansicht, dass genügend Zeit für eine Zufallsbewegung vorhanden ist. Newton hätte sich, denke ich, gefreut, dass die Natur ein einfaches Anstoßereignis zulässt, um etwas so Komplexes wie eine chemische Reaktion zu beschreiben", sagt Polanyi.
Das Team, zu dem auch die leitende wissenschaftliche Mitarbeiterin Lydie Leung, der Doktorand Matthew Timm und der Doktorand Kelvin Anggara gehörten, hatte zuvor die Möglichkeit geschaffen, zu steuern, ob ein Molekül, das auf ein anderes zugestoßen wird, entweder frontal mit seinem Ziel kollidiert oder es um einen bestimmten Betrag verfehlt - eine Größe, die als Stoßparameter bekannt ist. Je höher der Stoßparameter, desto größer ist der Abstand, um den das ankommende Molekül das Zielmolekül verfehlt. Für die neue Arbeit setzten die Forscher einen Impact-Parameter von Null ein, um eine Frontalkollision zu erreichen.
"Wir nennen diese neue Art der eindimensionalen chemischen Reaktion 'knock-on', da wir feststellen, dass das Produkt entlang der Fortsetzung der Richtung der Annäherung des Reagenzes angeklopft wird", sagt Polanyi. "Die Bewegungen ähneln dem Anklopfen der Stahlkugeln einer Newtonschen Wiege. Die Stahlkugeln der Wiege gehen nicht durch einander hindurch, sondern übertragen den Impuls effizient entlang einer einzigen Linie.
"In ähnlicher Weise übertragen unsere Knock-on-Reaktionen Energie entlang von Reihen von Molekülen und begünstigen so eine Kettenreaktion. Diese Erhaltung der Reaktionsenergie in der Knock-on-Chemie könnte nützlich sein, wenn sich die Welt in Richtung Energieerhaltung bewegt. Für den Moment dient sie als Beispiel für eine chemische Reaktion in ihrer einfachsten Form."
Seit weit über einem Jahrhundert ist bekannt, dass es eine Energiebarriere gibt, die chemische Reagenzien auf ihrem Weg zur Bildung von Reaktionsprodukten überwinden müssen. An der Spitze der Barriere existiert kurzzeitig ein energetisierter Übergangszustand in einer kritischen Konfiguration - kein Übergangszustand, keine Reaktion.
Polanyi sagt, dass die Beobachtung des kollinearen "Anklopfens" einen Einblick in den reaktiven Kollisionskomplex gibt, der etwa eine Million-Millionstel-Sekunde lang andauert. "Unsere Ergebnisse sagen uns deutlich, dass der Übergangszustand an der Spitze der Energiebarriere so wenig Zeit dauert, dass er seine Impulse nicht vollständig verwürfeln kann. Stattdessen merkt er sich die Richtung, aus der das angreifende Fluoratom kam."
In den 1930er Jahren begannen Chemiker, die Wahrscheinlichkeit der Bildung eines Übergangszustands unter der Annahme zu berechnen, dass er seine Energie wie ein heißes Molekül verwirbelt. Obwohl es sich um eine Annahme handelte, schien sie gut etabliert und führte zur statistischen "Übergangszustandstheorie" der Reaktionsraten. Dies ist immer noch die bevorzugte Methode zur Berechnung von Reaktionsgeschwindigkeiten.
"Mit der Möglichkeit, die Reagenzien und die Produkte auf molekularer Ebene zu beobachten, kann man nun genau sehen, wie sich die Reagenzien annähern und wie sich die Produkte anschließend trennen", sagt Polanyi. "Aber das steht im Widerspruch zum klassischen, 90 Jahre alten statistischen Modell. Wenn die Energie und der Impuls im heißen Übergangszustand randomisiert wären, würden die Produkte keine klare Erinnerung an die Annäherungsrichtung der Reagenzien aufweisen. Die Energie-Randomisierung würde dieses Gedächtnis auslöschen."
Die Forscher sagen, dass die beobachtete gerichtete Bewegung der Reaktionsprodukte ein deterministisches Modell des Übergangszustandes begünstigt, um das seit langem bestehende statistische Modell zu ersetzen. Zusätzlich erlaubt die beobachtete Reaktionsdynamik, dass die Energie der Reagenzien in aufeinanderfolgenden kollinearen Kollisionen weitergegeben wird.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.