Chemiker entdecken neue Reaktivität "gespannter" Moleküle
Lichtenergie ermöglicht Herstellung dreidimensionaler Moleküle durch Reaktion von Doppelbindungen mit Einfachbindungen
In der organischen Synthesechemie sind sogenannte Cycloadditionen eine besonders bedeutende Reaktionsklasse. Mit diesem Reaktionstyp werden ringförmige Molekülverbindungen einfach und effizient dadurch aufgebaut, dass zwei Verbindungen, die jeweils Doppelbindungen enthalten, zusammengefügt („addiert“) werden. Einem Team um Prof. Dr. Frank Glorius von der Westfälischen Wilhelms-Universität (WWU) Münster ist es nun gelungen, eine unkonventionelle Photocycloaddition durchzuführen, bei der eine Kohlenstoff-Kohlenstoff-Doppelbindung mit einer Kohlenstoff-Kohlenstoff-Einfachbindung reagiert. Bei Doppelbindungen sind Atome durch zwei Elektronenpaare verbunden, bei Einfachbindungen ist nur ein Elektronenpaar beteiligt. Der Schlüssel zum Erfolg war die Verwendung besonders „gespannter“ Einfachbindungen. Um zudem milde Reaktionsbedingungen gewährleisten zu können, nahmen die Chemiker einen Photosensibilisator zu Hilfe, also einen Katalysator, der die Reaktion mit Lichtenergie antreibt. Die Studie ist in der Fachzeitschrift „Nature“ veröffentlicht.

Die Münsteraner verwenden diesen Laboraufbau für die Photocycloaddition.
© University of Münster - Roman Kleinmans
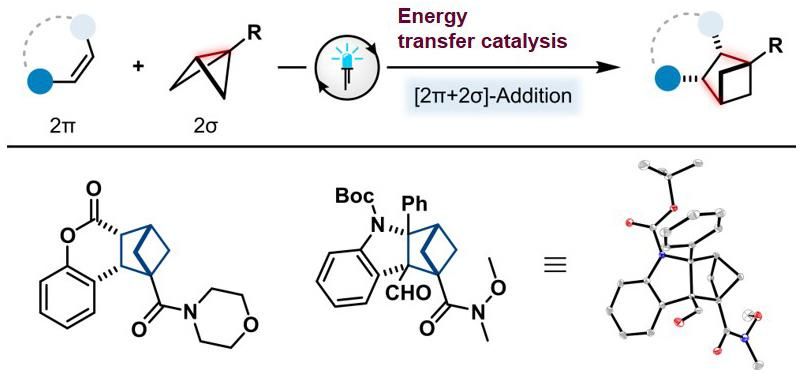
Die neue unkonventionelle Photocycloaddition; oben: schematische Darstellung der Reaktionsgleichung mit einer „schmetterlingsartigen“ Ausgangsverbindung (2σ); unten: Strukturen zweier Reaktionsprodukte (ganz rechts eine 3D-Darstellung/Kristallstrukturanalyse).
© University of Münster - Roman Kleinmans

„Neben der konzeptionellen und mechanistischen Relevanz hat diese Methode auch einen synthetischen Nutzen“, unterstreicht Erstautor Roman Kleinmans. „Denn wir können auf diese Weise polycyclische dreidimensionale Kohlenstoffgerüste aufbauen, die bislang nur schwer oder überhaupt nicht zugänglich waren. Solche dreidimensionalen Architekturen sind faszinierend und spielen in der Medizinalchemie eine zunehmend wichtige Rolle und sind daher von besonders großem Interesse.“
Die Chemie im Detail
Seit über einem Jahrhundert werden sogenannte [2+2]-Photocycloadditionen untersucht und weiterentwickelt. Dabei hat sich die Forschung konkret auf [2π+2π]-Systeme konzentriert, bei denen beispielsweise zwei Doppelbindungen unter Ausbildung zweier neuer Einfachbindungen zu einem viergliedrigen Ringprodukt reagieren. Dem münsterschen Team gelang nun ein Durchbruch, indem sie diese Art der Reaktion nun auch mit Einfachbindungen realisieren konnten („2π+2σ“).
Um die Reaktion zu ermöglichen, setzte das Team eine Verbindungsklasse mit „gespannter“ Einfachbindung ein: sogenannte Bicyclo[1.1.0]butane (BCBs). Diese Kohlenstoffverbindungen haben eine schmetterlingsartige Form mit zwei verknüpften Dreiecken an der Einfachbindung, die wie Flügel aussehen. Die inneren Flügelwinkel (je 60 Grad) weichen stark von den idealen, spannungsfreien Winkeln (je 109 Grad) ab. Durch das Öffnen der zentralen gespannten Einfachbindung wird Spannungsenergie frei – die Reaktion wird dadurch thermodynamisch begünstigt. Mit dieser Strategie gelang es den Forschern auch, ein Stickstoffatom in das Kohlenstoffgerüst des Produkts einzubauen.
Ferner erlaubt die von sichtbarem Licht angetriebene „Triplett-Triplett-Energietransferkatalyse“ eine möglichst milde Reaktionsdurchführung, sodass die Forscher eine sonst übliche Bestrahlung der Reaktion mit harschem UV-Licht vermeiden konnten. Bei dieser Art der Katalyse nimmt der Katalysator Energie des eingestrahlten Lichts auf und kann diese auf ein geeignetes Substrat übertragen. Der Katalysator gelangt zurück in den Grundzustand (er wird regeneriert), und das entsprechende Molekül befindet sich in einem energetisch angeregten Zustand (Triplett-Zustand). Das angeregte Molekül ist dann in der Lage, mit der Einfachbindung zu reagieren. „Wir haben dafür einen einfachen organischen Photosensibilisator verwendet, nämlich Thioxanthon, und konnten auf meist teure und begrenzt verfügbare Übergangsmetall-basierte Katalysatoren verzichten“, betont Frank Glorius. Den molekularen Mechanismus hinter der Reaktion berechneten die Chemiker per Dichtefunktionaltheorie. Dieses Verfahren wird zur Berechnung grundlegender Eigenschaften von Molekülen eingesetzt.































































