Göttinger Forschungsteam entschlüsselt Grundprinzip der Enzymkatalyse
Wie gleiche Ladungen in Enzymen biochemische Reaktionen steuern
Aus der Physik und Chemie ist allgemein bekannt, dass sich gleiche Ladungen gegenseitig abstoßen, während sich entgegengesetzte Ladungen anziehen. Man nahm lange Zeit an, dass dieses Prinzip auch gilt, wenn Enzyme – die biologischen Katalysatoren in allen lebenden Organismen – chemische Bindungen neu bilden oder aufbrechen. Daher wurde vermutet, dass Enzyme in ihren so genannten aktiven Zentren – also da, wo die chemischen Reaktionen tatsächlich stattfinden – Ladungen in einer derartigen Weise platzieren, dass diese gleichartige Ladungen auf den Substratmolekülen abstoßen. Dieses Konzept wird als „elektrostatischer Stress“ bezeichnet. Trägt das Substrat beispielsweise eine negative Ladung, könnte das Enzym eine negative Ladung nutzen, um das Substrat zu „stressen“ und so die Reaktion zu erleichtern. Eine Studie der Universität Göttingen und des Max-Planck-Instituts für Multidisziplinäre Naturwissenschaften in Göttingen hat nun unerwarteterweise gezeigt, dass zwei gleiche Ladungen nicht zwangsläufig zu einer Abstoßung führen, sondern eine Anziehung in Enzymen bewirken können. Die Ergebnisse sind in der Fachzeitschrift Nature Catalysis erschienen.
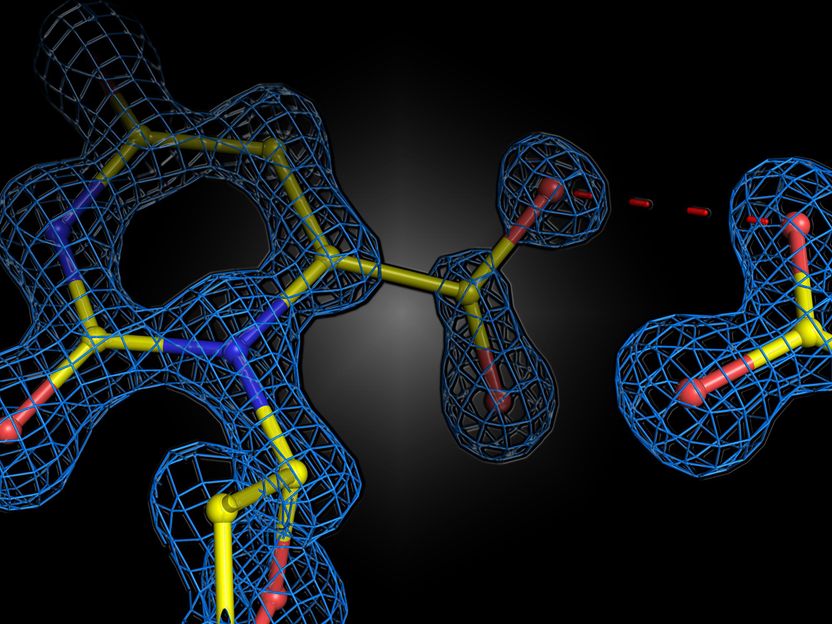
Struktureller Schnappschuss der enzymatischen Reaktion im humanen Enzym Orotidin-5‘-phosphat Decarboxylase. Die beiden negativen Ladungen des Substrats und Enzyms stoßen sich nicht ab, sondern gehen eine attraktive Wechselwirkung ein.
Kai Tittmann
Das Team studierte ein Enzym, das ein bekanntes und intensiv untersuchtes Lehrbuchbeispiel für Enzymkatalyse ist. Ohne das Enzym ist die Reaktion extrem langsam und läuft mit einer Halbwertszeit von 78 Millionen Jahren ab. Das Enzym beschleunigt die Reaktion um den beeindruckenden Faktor 1017, und zwar allein durch Positionierung von negativen und positiven Ladungen im aktiven Zentrum. Da das Substrat eine negativ geladene Gruppe enthält, die als Kohlendioxid abgespalten wird, war man jahrzehntelang davon ausgegangen, dass die negativen Ladungen des Enzyms das ebenfalls geladene Substrat stressen und die Reaktion beschleunigen würden. Dieser mechanistische Vorschlag blieb jedoch nur hypothetischer Natur, da die Reaktion zu schnell war, um strukturell beobachtet zu werden.
Der Gruppe von Prof. Dr. Kai Tittmann vom Göttinger Zentrum für Molekulare Biowissenschaften (GZMB) gelang es nun erstmals, mit Hilfe der Proteinkristallografie einen strukturellen Schnappschuss des Substrats kurz vor der chemischen Reaktion zu erhalten. Entgegen den Erwartungen stießen sich die negativen Ladungen von Enzym und Substrat nicht gegenseitig ab. Stattdessen teilten sie sich ein Proton als molekularen Klebstoff in einer attraktiven Wechselwirkung. „Die Frage, ob zwei gleiche Ladungen im Kontext der Enzymkatalyse Freunde oder Feinde sind, wird in unserem Fachgebiet seit langem kontrovers diskutiert, und unsere Studie zeigt, dass die grundlegenden Prinzipien der Funktionsweise von Enzymen noch lange nicht verstanden sind“, so Tittmann. Die kristallografischen Strukturen wurden anschließend von dem Quantenchemiker Prof. Dr. Ricardo Mata und seinem Team vom Institut für Physikalische Chemie analysiert. „Das zusätzliche Proton zwischen den beiden negativen Ladungen wird nicht nur dazu verwendet, das Substrat anzuziehen, sondern es löst eine Kaskade von Protonentransferreaktionen aus, die die Reaktion weiter beschleunigen“, erklärt Mata.
„Wir glauben, dass die entschlüsselten Prinzipien der Enzymkatalyse bei der Entwicklung von neuen chemischen Katalysatoren helfen werden“, sagt Tittmann. „Da das von uns untersuchte Enzym Kohlendioxid freisetzt, das wichtigste Treibhausgas, das durch menschliche Aktivitäten entsteht, könnten unsere Ergebnisse dazu beitragen, neue chemische Strategien für die Kohlendioxidbindung zu entwickeln.“
An der Studie waren Wissenschaftlerinnen und Wissenschaftler des Göttinger Zentrums für Molekulare Biowissenschaften (GZMB), der Fakultäten für Biologie und Psychologie sowie der Chemie der Universität Göttingen, des Max-Planck-Instituts für Multidisziplinäre Naturwissenschaften, des Europäischen Molekularbiologischen Labors (EMBL) Hamburg und der Universität von Toronto beteiligt. Die Publikation ist dem Andenken an den Mitautor Prof. Dr. Ulf Diederichsen gewidmet, der im vergangenen Jahr verstarb.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Sören Rindfleisch et al. Ground-state destabilization by electrostatic repulsion is not a driving force in orotidine-5′-monophosphate decarboxylase catalysis. Nature Catalysis 2022.
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Chemie-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.





























































