Bildgebung der kleinsten Atome gibt Einblicke in die ungewöhnliche Biochemie eines Enzyms
Dies könnte bei der Entwicklung von Enzymen für die chemische Industrie helfen
Wenn Ihre Wunden heilen und Ihre Leber ein aufgenommenes Gift wie Histamin entgiftet, können Sie der Enzymklasse der Kupferaminoxidasen für ihre Hilfe danken. Die genauen Positionen der kleinsten Wasserstoffatome in diesen Enzymen zu bestimmen, ist mit den üblichen Technologien schwierig, aber entscheidend für die Entwicklung verbesserter Enzyme, die eine ungewöhnliche, aber nützliche biochemische Reaktivität aufweisen.
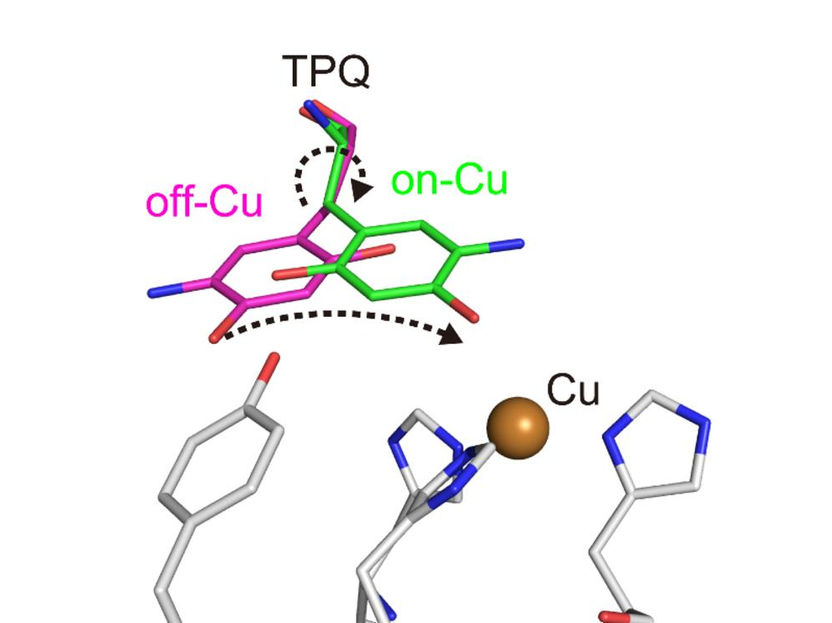
Konformationsänderung des Cofaktors TPQ während der Katalyse. TPQ nimmt eine Konformationsänderung von off-Cu zu on-Cu vor, wobei ein radikalisches Semichinon-Zwischenprodukt entsteht.
Takeshi Murakawa, Toshihide Okajima
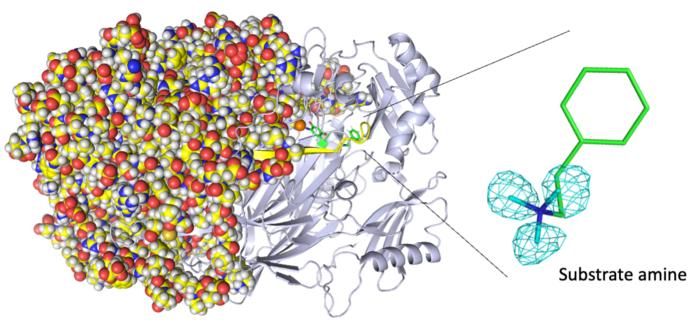
Vollständige Neutronenkristallstruktur der Kupferaminoxidase. (Links) Durch Neutronenkristallographie wurde die gesamte Proteinstruktur einschließlich der Wasserstoffatome bestimmt. (Rechts) Die genauen Positionen der Wasserstoffatome zeigen, dass es sich bei dem nachgewiesenen Molekül nicht um ein Produktaldehyd, sondern um ein Substratamin handelt. Die Karten für die Wasserstoffatome (genauer gesagt, das Deuterium) werden mit Hilfe eines cyanfarbenen Netzes dargestellt.
Takeshi Murakawa, Toshihide Okajima
In einer kürzlich in ACS Catalysis veröffentlichten Studie hat ein Team unter der Leitung von Forschern der Osaka Medical and Pharmaceutical University und der Osaka University die Neutronenkristallographie eingesetzt, um die Struktur eines Kupfer-Aminoxidase-Enzyms Atom für Atom darzustellen. Diese Studie bietet beispiellose strukturelle Einblicke in die Biochemie des Enzyms.
Einige Kupfer-Amin-Oxidase-Enzyme weisen eine ungewöhnliche Biochemie auf, wie z. B. das Quantentunneln, das ansonsten unerklärlich schnelle Reaktionsgeschwindigkeiten ermöglicht. Obwohl es oft schwierig ist, die genaue Position der einzelnen Wasserstoffatome im Enzym zu bestimmen, ist dieses Wissen wichtig für die Entwicklung entsprechender künstlicher Enzyme. Forscher erhalten die Atom-für-Atom-Struktur von Enzymen in der Regel durch Röntgenkristallographie. Bei dieser Technik werden die Strukturinformationen jedoch durch die Beugung von Elektronen im Enzym gewonnen. Daher ist sie für die Darstellung von Wasserstoffatomen, die im Allgemeinen nur ein Elektron enthalten, unzureichend. Die Neutronenkristallographie, die die Beugung von Atomkernen im Enzym analysiert (alle Atome haben einen Atomkern), ist eine alternative Abbildungsmethode, die die Forscher für ihre Arbeit gewählt haben.
"Es gibt Fragen zur pH-Abhängigkeit, zu Konformationsänderungen und zur Stabilisierung radikaler Zwischenstufen unseres Enzyms, die die Röntgenkristallographie allein nicht vollständig erklären kann", erklärt Takeshi Murakawa, Hauptautor der Studie. "Die Neutronenkristallographie ist gut geeignet, um diese Fragen zu beantworten."
Die Forscher gewannen zahlreiche Erkenntnisse. So konnten sie beispielsweise den Protonierungs-/Deprotierungszustand (bezogen auf den pH-Wert) von Stellen innerhalb des Enzyms abbilden, die für die Stabilisierung radikaler Spezies (d. h. besonders reaktiver Atome, die ein ungepaartes Elektron enthalten) wichtig sind. Sie charakterisierten auch die Bewegungen des Topachinon-Cofaktors des Enzyms - Gleiten, Aufwärtskippen und Halbrotation -, die den Transfer eines einzelnen Elektrons innerhalb des Enzyms erleichtern.
"Wir konnten die Bindung eines zweiten Moleküls eines hochaffinen Aminsubstrats während der enzymatischen Reaktion nachweisen, ein bisher unbekannter Vorgang im aktiven Zentrum des Enzyms", sagt Toshihide Okajima, Seniorautor. "Die Röntgenkristallographie lässt solche Erkenntnisse vermissen."
Diese Arbeit hat bisher unbekannte strukturelle Details in einem Kupfer-Aminoxidase-Enzym geliefert, das viele Funktionen im biochemischen Stoffwechsel hat. Die Aufdeckung der genauen Position der Wasserstoffatome im Enzym trägt dazu bei, seine Effizienz bei physiologischen Temperaturen und Drücken zu erklären. In Zukunft könnten die Forscher diese Erkenntnisse für die Entwicklung künstlicher Enzyme nutzen, die in der chemischen Industrie eingesetzt werden.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.
Originalveröffentlichung
Takeshi Murakawa, Kazuo Kurihara, Mitsuo Shoji, Naomine Yano, Katsuhiro Kusaka, Yoshiaki Kawano, Mamoru Suzuki, Yasuteru Shigeta, Takato Yano, Motoyasu Adachi, Katsuyuki Tanizawa, Toshihide Okajima; "Neutron Crystallography of a Semiquinone Radical Intermediate of Copper Amine Oxidase Reveals a Substrate-Assisted Conformational Change of the Peptidyl Quinone Cofactor"; ACS Catalysis, Volume 13, 2023-9-7






























































