Warum Fische im Eismeer nicht einfrieren: RUB-Chemiker entlarven natürlichen Frostschutz
Anti-Freeze-Protein beeinflusst die Bewegung umgebender Wassermoleküle
Bochumer Forscher haben herausgefunden, wie der natürliche Frostschutz funktioniert, der Fische im Eismeer vor dem Erfrieren schützt. Sie konnten beobachten, dass ein Gefrierschutzprotein im Fischblut die Wassermoleküle in seiner Umgebung so verändert, dass ein Ausfrieren unmöglich wird und das Ganze flüssig bleibt. Dabei besteht zwischen Protein und Wasser keine chemische Bindung - die Anwesenheit des Proteins genügt.
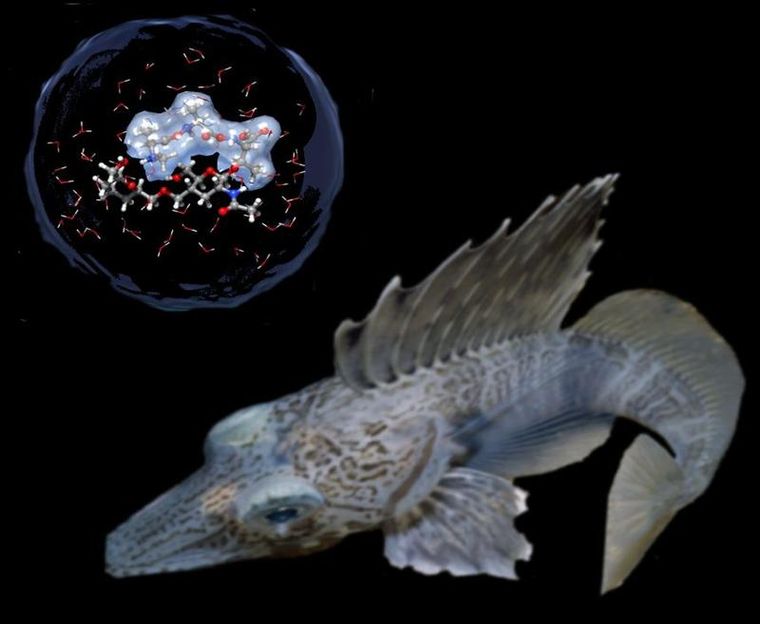
Der Fisch Macropteris maculatus aus dem McMurdo-Sund in der Antarktis. Das Anti-Freeze-Protein - oben die schematische Struktur mit der erweiterten Hydrathülle - verhindert, dass er im Eismeer gefriert.
Konrad Meister
Gemeinsam mit Kooperationspartnern aus den USA beschreiben die Forscher um Prof. Dr. Martina Havenith-Newen (Physikalische Chemie II der RUB) ihre Entdeckung in einer sog. Rapid Communication im Journal of the American Chemical Society (JACS). Die unabhängigen Gutachter des Journals werteten die Arbeit als eine der besten 5% aller Einsendungen.
Besser als haushaltsübliche Frostschutzmittel
Bei Temperaturen von minus 1,8° C müsste eigentlich jeder Fisch erstarren: Der Gefrierpunkt für Fischblut liegt bei ungefähr minus 0,9° C. Warum antarktische Fische bei diesen Temperaturen trotzdem beweglich bleiben, interessiert die Forschung seit langem. Schon vor 50 Jahren wurden besondere Gefrierschutzproteine im Blut dieser Fische entdeckt. Diese sog. Anti-Freeze-Proteine funktionieren besser als jedes haushaltsübliche Frostschutzmittel. Wie sie aber funktionieren, war bislang noch ungeklärt. Die Bochumer Forscher setzten ihre Spezialität ein, die Terahertz-Spektroskopie. Mit Hilfe von Terahertz-Strahlung lassen sich die kollektiven Bewegungen von Wassermolekülen und Proteinen beobachten. So konnte die Arbeitsgruppe schon zeigen, dass Wassermoleküle, die in flüssigem Wasser normalerweise einen ständigen Tanz aufführen und dabei immer neue Bindungen untereinander eingehen, in Anwesenheit von Proteinen geordneter tanzen - „aus dem Discotanz wird ein Menuett“, schildert Prof. Havenith-Newen.
Mitbringsel einer Antarktis-Expedition
Gegenstand der aktuellen Untersuchungen waren Anti-Freeze-Glycoproteine des antarktischen Seehechts Dissostichus mawsoni, den einer der amerikanischen Kooperationspartner, Arthur L Devries, eigens auf einer Antarktis-Expedition gefischt hatte. „Wir konnten sehen, dass das Protein einen besonders weitreichenden Einfluss auf die Wassermoleküle in seiner Umgebung hat, wir sprechen von einer erweiterten Hydrathülle“, erklärt Mitautor Konrad Meister. „Dieser Einfluss, der die Eiskristallisation verhindert, ist bei tiefen Temperaturen sogar ausgeprägter als bei Zimmertemperatur“, setzt Prof. Havenith-Newen hinzu. Um das Wasser dennoch zum Gefrieren zu bringen, wären tiefere Temperaturen nötig. Wenn man das Protein durch einen speziellen Boratpuffer deaktiviert, funktioniert der Gefrierschutz nicht mehr. In diesem Fall fanden die Forscher auch keine Änderung des Terahertz-Tanzes. Mit ihrer Beobachtung entkräfteten die Forscher die bisherige Annahme, dass eine einzige Bindungsstelle zwischen Anti-Freeze-Protein und Wasser für die Aktivität des Proteins verantwortlich ist. Mit der Untersuchung gelang zum ersten Mal der Nachweis eines direkten Zusammenhangs zwischen der Funktion eines Proteins und seiner Signatur im Terahertz-Bereich. Die Untersuchungen wurden von der VolkswagenStiftung gefördert.
Originalveröffentlichung: Simon Ebbinghaus et al.; "Antifreeze glycoprotein activity correlates with long-range protein-water dynamics"; Journal of the American Chemical Society. August 16, 2010
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!