Fehler bringen Reaktionsbeschleuniger in Fahrt
Einsichten zu dem Katalysator, der Kohlendioxid in Methanol umwandelt, könnten das Recycling des Treibhausgases ermöglichen
In chemischen Produktionsstätten gibt es nun ein Geheimnis weniger. Seit Jahrzehnten produziert die Industrie im großen Stil Methanol aus einem Gemisch von Kohlendioxid und Kohlenmonoxid sowie Wasserstoff. Ein internationales Team um Chemiker des Fritz-Haber-Instituts der Max-Planck-Gesellschaft in Berlin hat nun aufgeklärt, warum der dabei verwendete Katalysator aus Kupfer- und Zinkoxidpartikeln mit einem kleinen Aluminiumoxidanteil so gut funktioniert. Sie erkannten dabei auch, warum dieser Reaktionsbeschleuniger auf die bewährte Art und Weise hergestellt werden muss. Wie die Forscher feststellten, machen erst Defekte und eine bislang unbekannte Vermischung von Kupfer und Zinkoxid den Katalysator so aktiv. Diese Erkenntnisse können zum einen dazu beitragen, den Katalysator weiter zu verbessern. Zum anderen helfen sie den Forschern, Katalysatoren zu entwickeln, die reines Kohlendioxid effizient umsetzen. Mit diesen ließe sich das Treibhausgas, das bei der Verbrennung fossiler Brennstoffe entsteht, wiederverwerten.
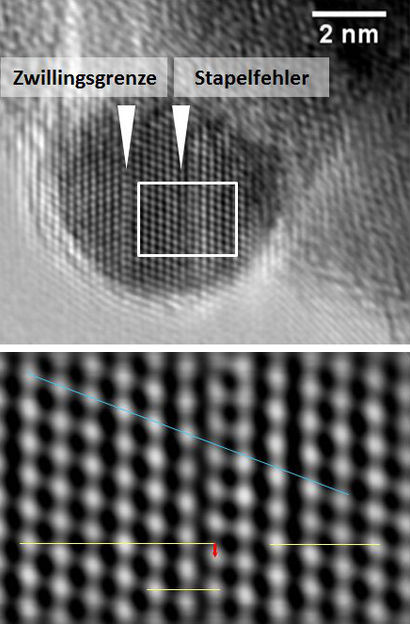
Fehler als Erfolgsrezept: Die Aufnahmen des hochauflösenden Transmissions-Elektronenmikroskops zeigen die Anordnung der einzelnen Atome in einem Kupferteilchen. Die Pfeile markieren Stapelfehler und Zwillingsgrenzen. Im Detail-Bild ist der Stapelfehler daran zu erkennen, dass die Atome (weiße Punkte) ab einer bestimmten Stelle von der blauen Linie abweichen. Wie stark, markiert der rote Pfeil an der gelben Linie im unteren Bildteil. Die Defekte in der Kristallstruktur machen sich auch an der Oberfläche der Partikel bemerkbar und erhöhen die Aktivität des Katalysators.
© Malte Behrens / Fritz-Haber-Institut der MPG
Recycling könnte das Problem des Kohlendioxid-Ausstoßes etwa von Kohlekraftwerken elegant lösen. Nicht nur, dass das Gas dann nicht mehr dem Klima einheizen würde. Mit Methanol etwa ließen sich fossile Rohstoffe zumindest teilweise ersetzen, vor allem aber ließe sich darin regenerative Energie speichern. „Ohne Energiespeicher ist die Energiewende nicht möglich“, sagt Robert Schlögl, Direktor am Fritz-Haber-Institut der Max-Planck-Gesellschaft. Denn das Stromangebot von Windrädern und Solaranlagen wird stark schwanken und sich nicht am Bedarf orientieren. Die Erkenntnisse des Forscherteams um die Chemiker des Fritz-Haber-Instituts könnten dazu beitragen, Katalysatoren zu entwickeln, die Kohlendioxid aus der Verbrennung von Kohle, Gas oder Öl mit Wasserstoff effizient in Methanol oder andere chemische Energiespeicher umwandeln.
Neben den Berliner Max-Planck-Forschern waren an der Arbeit auch Wissenschaftler des Berliner Helmholtz-Zentrums für Materialien und Energie sowie des SLAC National Accelerator Laboratory im kalifornischen Menlo Park, der Universität Stanford und der Südchemie AG beteiligt. Die Forscher haben den Katalysator untersucht, mit dem die Industrie bereits heute jährlich 50 Millionen Tonnen Methanol erzeugt. Sie verwendet dazu allerdings ein Gemisch aus Kohlendioxid und Kohlenmonoxid, das Raffinerien dazu eigens aus Erdgas oder Kohle produzieren. „Erst wenn wir verstehen, warum dieser Katalysator so gut funktioniert und warum er auf dem bewährten Weg hergestellt werden muss, können wir ihn optieren und für die Umsetzung von reinem Kohlendioxid weiterentwickeln“, sagt Malte Behrens, der an der Aufklärung des Katalysator-Geheimnisses maßgeblich beteiligt war.
Wo verbandeln sich die Moleküle?
Der industriell eingesetzte Katalysator setzt sich aus zahllosen Nanopartikeln zusammen, die teils aus Kupfer und teils aus Zinkoxid mit einem kleinen Anteil Aluminiumoxid bestehen und eine Art Nanoschwamm bilden. Malte Behrens und seine Kollegen haben in dem Konglomerat nun die Stellen identifiziert, an denen sich Kohlendioxid- und Kohlenmonoxid-Moleküle über verschiedene Zwischenschritte mit ihren Wasserstoffpartnern verbandeln. Auf Aufnahmen eines hochauflösenden Transmissions-Elektronenmikroskops (HRTEM) und mithilfe der Neutronenstreuung, die Aussagen über die Kristallstruktur ermöglicht, entdeckten die Wissenschaftler Fehler in der Anordnung der Kupferatome in den Nanopartikeln. In quantenchemischen Rechnungen belegten sie anschließend, dass sich einige der Zwischenprodukte bevorzugt an diesen Defekte anlagern. Das bedeutet: Die Defekte erhöhen die Aktivität des Katalysators, da seine Aufgabe genau darin besteht, die Bildung dieser Zwischenprodukte zu fördern.
Zudem fanden die Wissenschaftler heraus, warum das Zinkoxid eine tragende Rolle in dem Gemisch spielt. Sie untersuchten den Nanoschwamm mit der Synchrotronstrahlung des Elektronenspeicherrings Bessy II am Helmholtz-Zentrum Berlin für Materialien und Energie. Mit dem Röntgen-Anteil dieser Strahlung erzeugten sie Photoelektronen, die extrem detaillierte Auskunft über die chemische Zusammensetzung von Oberflächen geben. Das Instrument dafür hatten sie eigens für die Charakterisierung von Katalysatoren entwickelt. In diesen Analysen sowie auf den HRTEM-Bildern stellten sie fest, dass Zinkoxid auch über Teile der Kupferteilchen kriecht und manche Atome in der Kupferoberfläche sogar durch Zink ersetzt werden. Auch das macht den Katalysator besonders aktiv. Denn wiederum ergaben Rechnungen, dass einige Zwischenprodukte der Reaktion – in diesem Fall die sauerstoffhaltigen – eher am Zink als am Kupfer binden.
Lange galt einzig das Kupfer als katalytisch aktive Komponente. Die Katalyse-Forschung konzentrierte sich daher darauf, seine Oberfläche zu vergrößern, weil auf der größeren Oberfläche mehr Moleküle Platz für die chemische Transformation finden. Dem Zinkoxid dachten Chemiker lange nur die Rolle eines Abstandshalters zu. Er sollte verhindern, dass die Kupferpartikel in der Hitze der Reaktion miteinander verschmelzen. Diese Aufgabe erfüllen die Zinkoxid-Teilchen auch, aber seit einigen Jahren steht fest, dass Zinkoxid noch einen anderen Einfluss ausübt. Denn ähnliche schwammartige Strukturen aus Kupfer und anderen Metallen als Zink weisen zwar auch eine große Oberfläche auf, bringen es aber längst nicht auf die Aktivität des Kupfer-Zink-Aluminium-Systems. „Es wurden verschiedene Effekte des Zinkoxids diskutiert“, sagt Malte Behrens. „Unsere Untersuchungen helfen nun, seine Rolle endgültig zu klären.“
Suche nach Katalysatoren jenseits von Versuch und Irrtum
Dank der Erkenntnis, welche Strukturdetails den bewährten Katalysator der Methanol-Synthese auszeichnen, verstehen die Wissenschaftler nun auch, warum die Präparation des Reaktionsbeschleunigers so diffizil ist. Der Katalysator entsteht in mehreren Stufen aus Lösungen von Kupfer- und Zinksalzen. Aus diesen erzeugen Chemiker zunächst eine Vorstufe des Katalysators, indem sie die beiden Metalle als Carbonate abscheiden. „Bei welchem pH-Wert und bei welcher Temperatur wir die Vorstufe herstellen, entscheidet über die Aktivität des Katalysators“, sagt Malte Behrens. „Der Katalysator besitzt ein chemisches Gedächtnis.“ Jetzt kann der Chemiker auch erklären, woran sich der Katalysator erinnert: Nur in der bewährten Prozedur kristallisiert das Kupfer nämlich mit kleinen Fehlern und kriecht das Zink über und in das Kupfer.
Relevant sind diese Ergebnisse nicht nur, weil sie helfen könnten, die Methanol-Synthese zu verbessern und für das Recycling von Abgasen zu trimmen. „Unsere Arbeit zeigt auch, dass wir Katalysatoren nur dann wirklich verstehen, wenn wir sie in ihrer gesamten Komplexität erfassen“, sagt Robert Schlögl. Schon oft nämlich haben Forscher den katalytischen Prozess der Methanol-Synthese studiert, aber stets an idealisierten Modellsystemen. Die lassen sich zwar einfacher untersuchen und auch theoretisch beschreiben, aber gerade so entscheidende Details wie Defekte kommen in ihnen nicht vor. Zudem stehen die Erkenntnisse für einen Paradigmenwechsel in der Katalyse-Forschung. „Neue Katalysatoren wurden bisher meist in Versuch und Irrtum gefunden“, sagt Robert Schlögl. „Unsere Arbeit zeigt, dass wir Katalysatoren und ihre Herstellung im Detail verstehen können. Das ermöglicht es und, Katalysatoren künftig auch rational, also am Reißbrett zu entwickeln.“