Forscher entwickeln Katalysatormaterial für Brennstoffzellen
Platin-Nickel-Nanooktaeder sparen 90 Prozent Platin
Leistungsfähige, robuste und günstige Katalysatormaterialien sind ein Schlüssel zum Durchbruch der Brennstoffzelltechnologie. Ein Material für die Umwandlung von Wasserstoff und Sauerstoff zu Wasser, das mit einem Zehntel der bisher typischen Menge Platin auskommt, entwickelten nun Wissenschaftler aus Jülich und Berlin. Mit Hilfe modernster Elektronenmikroskopie fanden die Forscher dabei heraus, dass die Funktion der nanometerkleinen Katalysatorpartikel entscheidend durch ihre geometrische Form und die atomare Struktur bestimmt wird. Diese Erkenntnis zeigt neue Wege auf, Katalysatoren für die Energieumwandlung und -speicherung weiter zu verbessern.

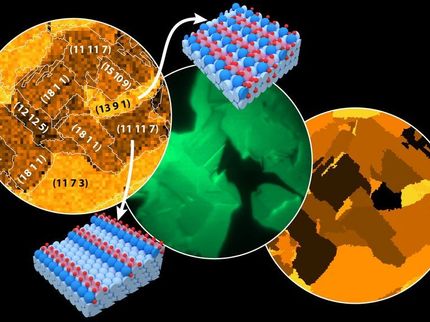
Elektronenmikroskopische Aufnahme und atomistisches Modell (unten rechts) eines hochaktiven sauerstoffaktivierenden Platin-Nickel-Katalysatorteilchens. Sein Durchmesser ist ungefähr zehntausendmal kleiner als der Durchmesser eines menschlichen Haares. Rote Kugeln symbolisieren Platinatome, grüne Nickelatome. Eine Eigenschaft solcher Oktaeder ist, dass die meisten Oberflächenatome dieselbe geometrische Anordnung besitzen. Die Aufnahme ist am Elektronenmikroskop PICO am ER-C entstanden.
Forschungszentrum Jülich/TU Berlin
Wasserstoffbetriebene Brennstoffzellen gelten als saubere Alternative zu konventionellen Verbrennungsmotoren, weil bei ihrem Betrieb neben elektrischer Energie nur Wasser entsteht. Ein Hindernis für die Durchsetzung von Wasserstoffbrennstoffzellen sind gegenwärtig die hohen Materialkosten für Platin. Noch werden große Mengen des teuren Edelmetalls für die Elektroden der Brennstoffzellen benötigt, an denen die chemischen Umwandlungsprozesse stattfinden. Ohne die Katalysatorwirkung des Platins lassen sich derzeit nicht die notwendigen Umwandlungsgeschwindigkeiten erreichen.
Da die Katalyse nur an der Oberfläche des Platins stattfindet, lässt sich Material sparen und gleichzeitig die Leistungsfähigkeit der Elektroden verbessern, indem man Platinnanopartikel verwendet und dadurch das Verhältnis von Platinoberfläche zu Materialeinsatz vergrößert. Die winzigen Teilchen sind etwa zehntausendmal kleiner als der Durchmesser eines menschlichen Haares, ein Kilogramm von ihnen kann aber die Oberfläche mehrerer Fußballfelder haben.
Noch mehr Platin spart die Mischung mit anderen, weniger wertvollen Metallen, wie Nickel oder Kupfer. Wissenschaftlern des Forschungszentrums Jülich und der Technischen Universität Berlin ist es nun gelungen, effiziente Metallkatalysatorpartikel für die Umwandlung von Wasserstoff und Sauerstoff zu Wasser zu entwickeln, die mit einem Zehntel der bisher typischen Menge Platin auskommen.
Der neue Katalysator besteht nicht aus den bisher üblichen runden Nanopartikeln, sondern aus oktaedrisch geformten Nanoteilchen einer Platin-Nickel-Legierung. Die Forscher fanden heraus, dass sich auf den Oberflächen dieser Teilchen die Platin- und Nickel-Atome ausschließlich so anordnen, dass sie die chemische Reaktion von Wasserstoff und Sauerstoff zu Wasser optimal beschleunigen. Ein rundes oder würfelförmiges Partikel dagegen besitzt andere atomare Anordnungen an der Oberfläche und katalysiert daher die chemische Reaktion weniger effizient, was durch einen Mehreinsatz an Edelmetall kompensiert werden müsste.
Wie die Lebensdauer der Katalysatoren von ihrer atomaren Komposition abhängt und sich optimieren lässt, untersuchte das Forscherteam mit Hilfe ultrahochauflösender Elektronenmikroskopie am Ernst Ruska-Centrum (ER-C), einer Einrichtung der Jülich Aachen Research Alliance. "Entscheidend beim Verständnis der Lebensdauer der Katalysatoren war die Beobachtung, dass Nickel und Platinatome sich nicht gleichverteilt an der Oberfläche der Nanooktaeder platzieren wollen", erläutert Dr. Marc Heggen vom ER-C und vom Jülicher Peter Grünberg Institut. "Dies ist zwar für die Reaktivität von Vorteil, begrenzt aber die Lebensdauer."
Um mit atomarer Genauigkeit zu erkennen, wo sich welches Element befindet, nutzten die Forscher eine Methode, bei der der Elektronenstrahl eines der weltweit höchstauflösenden Elektronenmikroskope fein gebündelt durch die Probe geschickt wird und durch die Wechselwirkungen mit der Probe einen Teil seiner Energie verliert. Jedes Element in der Probe kann damit wie mit einem Fingerabdruck identifiziert werden. Herkömmliche Elektronenmikroskope können solche chemischen Signaturen nicht mit atomarer Auflösung erkennen.
"Insgesamt liefert diese bahnbrechende experimentelle Arbeit den direkten Beweis, dass eine richtige Wahl der geometrischen Form der Katalysatorpartikel für die Optimierung ihrer Funktion ebenso wichtig ist wie die Wahl ihrer Zusammensetzung und ihrer Größe", betont Prof. Peter Strasser von der Technischen Universität Berlin. "Dies gibt Forschern neue Möglichkeiten an die Hand, Funktionsmaterialien, insbesondere Katalysatoren für die Energiespeicherung immer weiter zu verbessern." Aktuellste Arbeiten aus der Arbeitsgruppe Strasser deuten darauf hin, dass große Effizienzsprünge auch für die Spaltungsreaktion von Wasser in Sauerstoff in Elektrolyseuren möglich sind, wo das noch teurere Edelmetall Iridium zum Einsatz kommt.