Wie das Wasser tanzen lernt
Wassermoleküle, die im Kreis tanzen - an der TU Wien wurden die komplizierten Vorgänge auf der Oberfläche einer wichtigen Materialsorte entschlüsselt.

Der Atomtanz auf der Kristalloberfläche.
Copyright: TU Wien
Perowskite sind Materialien, die in Batterien, in Brennstoffzellen oder auch in elektronischen Bauteilen verwendet werden, aber auch in der Natur als Mineral vorkommen. Obwohl sie technologisch so wichtig sind, weiß man über das chemische Verhalten ihrer Oberfläche bis heute sehr wenig. Dem Team von Prof. Ulrike Diebold (Institut für Angewandte Physik, TU Wien) gelang es nun allerdings mit Hilfe von Rastertunnelmikroskopen und Computerberechnungen eine alte Frage zu klären: Wie verhalten sich Wassermoleküle, die sich auf den Perowskit-Oberflächen anlagern? Nicht nur die äußersten Atome an der Oberfläche, sondern auch tieferliegende Strukturen spielen dabei eine wichtige Rolle. Die Ergebnisse wurden nun im Fachjournal „Nature Materials“ veröffentlicht.
Perowskit zerlegt Wassermoleküle
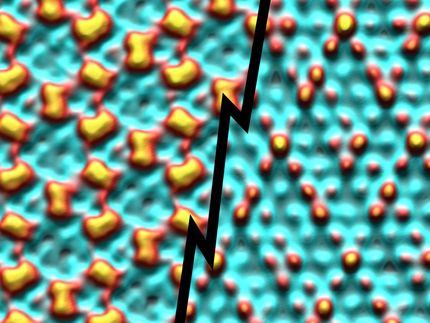
„Wir studierten Strontium-Ruthenat, einen ganz typischen Vertreter aus der Materialklasse der Perowskite“, sagt Ulrike Diebold. Es handelt sich um eine Kristallstruktur aus Sauerstoff, Strontium und Ruthenium. Die äußerste Schicht wird (wenn man den Kristall in der richtigen Richtung spaltet) nur von Strontium und Sauerstoff-Atomen gebildet, das Ruthenium befindet sich darunter, eingesperrt in eine Box aus Sauerstoff-Atomen.
Wassermoleküle, die auf diese Oberfläche auftreffen, werden in zwei Teile zerlegt: Eines der der Wasserstoffatome wird dem Molekül entrissen und von einem Sauerstoffatom der Kristalloberfläche festgehalten. Übrig bleibt eine OH-Gruppe, die durch eine sogenannte Wasserstoff-Brückenbindung an das entrissene Wasserstoffatom gebunden bleibt.
Genau diese Bindung ist die Ursache für einen merkwürdigen Effekt: Die OH-Gruppe kann sich nicht frei bewegen. Sie hüpft rund um das Wasserstoffatom herum, von Atom zu Atom, wie ein Tänzer, der mit einem Bein immer am selben Ort bleiben muss und bloß mit dem anderen verschiedene Schritte ausprobiert. „Aufgrund von theoretischen Berechnungen wurde dieser Effekt schon vor einigen Jahren vorhergesagt, wir sind nun die ersten, die das experimentell bestätigen konnten“, sagt Ulrike Diebold. Sie und ihr Team verfügen über langjährige Erfahrung im Abbilden atomarer Prozesse mit Rastertunnelmikroskopen. Wenn man eine bestimmte Region der Kristalloberfläche über längere Zeit immer wieder abbildet, kann man den Tanz der Atome auf der Oberfläche tatsächlich mitfilmen.
Musterbildung: Vom Einzeltänzer über Paarbindung zur Polonaise
Wenn man mehr Wasser auf die Oberfläche aufbringt kann es passieren, dass zwei Tänzer aufeinandertreffen. Dann müssen die OH-Gruppen ihren Tanzschritt ändern: „Die OH-Gruppe kann sich nur dann ungehindert im Kreis bewegen, wenn keiner der unmittelbar benachbarten Plätze besetzt ist“, sagt Florian Mittendorfer, der die Rechnungen gemeinsam mit seinem Dissertanten Wernfried Mayr-Schmölzer durchgeführt hat. Wenn man ein zweites Wassermolekül danebensetzt, hört die Bewegung auf – so als würden einander zwei Tanzpartner treffen und plötzlich eng umschlugen am selben Ort bleiben.
Solche Paare bilden sich allerdings nur an ganz bestimmten Stellen der Oberfläche – und das obwohl die oberste Schicht aus regelmäßig, symmetrisch angeordneten Sauerstoff und Strontium-Atomen besteht und somit alle Stellen gleichwertig sein sollten. Der Grund liegt an der Struktur unmittelbar unterhalb der Oberfläche: hier verbergen sich Oktaeder aus Sauerstoffatomen mit einem Ruthenium-Atom in der Mitte. Diese Oktaeder sind jedoch nicht alle gleich ausgerichtet, sondern ein bisschen zueinander verdreht – abwechselnd im und gegen den Uhrzeigersinn. Dadurch wird die Symmetrie der Oberfläche gebrochen und bestimmte Stellen für die Paarbildung bevorzugt. „Zunächst bilden sich Paare, dann entstehen ganze Ketten, die immer dichter werden, bis fast die ganze Oberfläche bedeckt ist.“ Was als Einzeltanz begann und zu Paarbindung führte endet bei zunehmender Konzentration von Wassermolekülen als große, geordnete Struktur, vergleichbar mit einer Polonaise, bei der viele Tanzpaare wohl! geordnet hintereinander aufgereiht sind.
Allerdings muss auch bei diesem Prozess an irgendeinem Punkt Schluss sein: Wenn alle Plätze besetzt sind, kann kein zusätzlicher Tänzer mehr auf der Tanzfläche untergebracht werden. „Wenn ein Wassermolekül auf eine Stelle trifft, an der ringsherum bereits alle Plätze von dissoziiertem Wasser besetzt sind, dann kann dieses neue Molekül nicht auch noch von der Oberfläche dissoziiert werden“, erklären die Forscher. Das Wassermolekül bleibt dann ganz, es adsorbiert molekular.
Die neuen Methoden, die vom Forschungsteam an der TU Wien entwickelt und angewandt werden, haben die Oberflächenforschung entscheidend verändert. War man früher auf indirekte Messungen angewiesen, kann man heute – mit dem nötigen Know-How – das Verhalten der einzelnen Atome auf der Oberfläche direkt abbilden und beobachten. Für die moderne Materialforschung eröffnet das ganz neue Möglichkeiten, beispielsweise für die Entwicklung und Verbesserung von Katalysatoren.