Enzyme und ihre Bewegungen ohne Marker direkt beobachten
Mit einem plasmonischen Nanosensor lassen sich auch chemische Reaktionen beobachten
Biologie und Medizin dürften davon sehr profitieren: Forscher des Max-Planck-Instituts für die Physik des Lichtes in Erlangen haben eine Methode entwickelt, um die Arbeitsweise von Enzymen und anderen Biomolekülen direkt zu beobachten. Damit haben sie unter anderem zum ersten Mal alleine mit Licht und ohne Farbstoff-Markierung verfolgt, wie sich das Enzym Polymerase bewegt, das im Körper die Erbsubstanz DNA herstellt. Da sich mit der Methode auch untersuchen lässt, wie Enzyme arbeiten, könnte sie helfen, neue Ansatzpunkte für medizinische Wirkstoffe zu identifizieren.

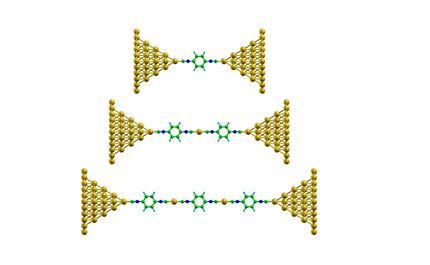
Wählerische Moleküle: Moleküle mit Aminogruppen (pink) heften sich an hervorstehende Goldatome auf der Oberfläche des Nanodrähtchens. Moleküle mit Thiol-Gruppen (blau) dagegen heften sich an, die Gold Atome die in der Oberfläche eingebettet sind. Ob die adsorbierten Moleküle auch miteinander reagieren, hängt davon ab, ob die Reaktionsbedingungen, genauer gesagt der pH-Wert, die Ionenstärke und die Temperatur, stimmen. Da die Reaktion im Sensor-Signal erkennbar wird, lassen sich Oberflächenreaktionen mit Hilfe des plasmonischen Nanosensors schnell optimieren.
© Frank Vollmer / Advanced Materials
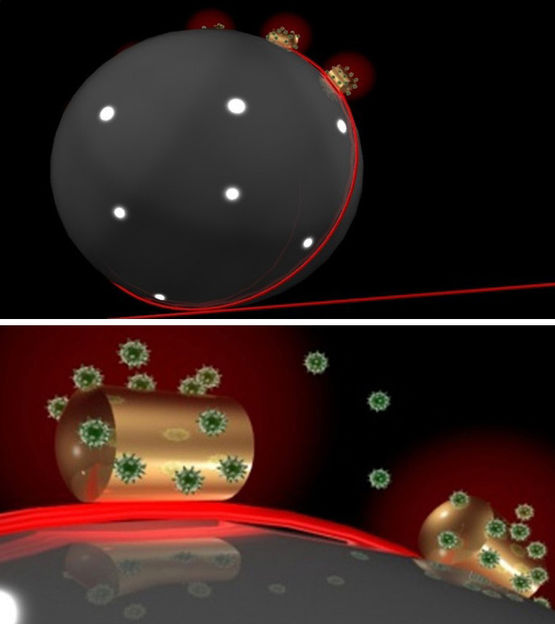
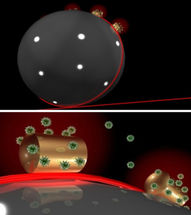
Ein Sensor auf einem Sensor: In eine Mikrokugel aus Glas, auf der Gold-Nanodrähtchen befestigt sind, Laserlicht (rot) eingestrahlt (oben). Das Laserlicht zirkuliert in der Mikrokugel und wird an den Gold-Drähtchen gebündelt, an die sich Biomoleküle (hier Proteine) heften können (unten). Sobald sich das Molekül bewegt und sich der Überlapp mit dem Lichtfeld ändert, zeichnet der Sensor ein Signal auf. So können etwa Enzyme und ihre Bewegungen ohne Marker beobachtet werden.
© Frank Vollmer / Science Advances

Nachweis für einzelne Ionen: Der Sensor ist so empfindlich, dass in seinen Signalen sogar zu erkennen ist, wenn sich einzelne Ionen an die hier idealisiert dargestellte Spitze des Nanodrähtchens auf der gläsernen Mikrokugel heften.
© Frank Vollmer / Nature Photonics

Ein Enzym legt Hand: Wenn eine DNA-Polymerase an das Golddrähtchen eines plasmonischen Nanosensors bindet und einen DNA-Strang synthetisiert ist das im Signal des Sensors zu erkennen. Denn während dieses Prozesses öffnet und schließt sich das Enzym wie eine Hand, sodass sich der Überlapp mit dem Lichtfleck an dem Golddrähtchen ändert. Da durch verändert sich auch die Wellenlänge des Lichts, das in der Mikrokugel zirkuliert, was die Forscher als Maß für den Überlapp nutzen.
© Frank Vollmer / Science Advances



Wenn Biologen durch ein modernes Mikroskop blicken, gleicht das dem nächtlichen Blick auf eine Straße: Fahrzeuge sind dort nur an ihren Scheinwerfern zu erkennen. Ob die leuchtenden Punkte aber zu einem PKW oder einem Lastwagen gehören, oder ob an einem stehenden Auto eine Tür geöffnet wird, lässt sich so nicht erkennen. Auch Biologen können Enzyme bei ihrer Arbeit nur indirekt beobachten. Sie heften leuchtende Farbstoffe an einzelne Komponenten der Biomoleküle und verfolgen dann mit einem Mikroskop das Zappeln der Lichtpunkte. Wie sich dabei die Form eines Enzyms ändert, ist so kaum zu erkennen. Außerdem sehen sie kein vollkommen naturbelassenes Enzym, weil daran stets Farbstoffmoleküle hängen. Und es ist nicht auszuschließen, dass diese die Funktion eines Enzyms beeinflussen.
Forscher um Frank Vollmer, der bis vor kurzem eine Forschungsgruppe am Max-Planck-Institut für die Physik des Lichts leitete und nun Professor an der Universität Exeter ist, haben jedoch eine Methode entwickelt, mit der sie Enzyme ohne die leuchtenden Anhängsel beobachten können.
Ein Nanodrähtchen bündelt Licht auf wenige Nanometer
Ihr mikroskopisch kleines Instrument ist sozusagen ein Sensor auf einem Sensor. Auf Glaskügelchen von etwa 80 Mikrometern (Tausendstel Millimeter) Durchmesser sitzt ein Nanodrähtchen aus Gold, von rund 10 Nanometer Durchmesser und 40 Nanometer Länge. Entlang der Innenseite des Kügelchens läuft eine Lichtwelle, die von einem Laser stammt. Da sie ein wenig aus dem Kügelchen heraus lappt, kommt es zu einer Wechselwirkung mit dem darauf befestigten Nanodrähtchen.
Diese ist zunächst nicht sehr stark. Doch das Kügelchen wirkt ähnlich einer Flüstergalerie: In einem Rundbau ist ein entlang der Wand geflüstertes Wort an der gegenüberliegenden Seite zu verstehen, weil die Schallwellen der Rundung folgen, anstatt sich in alle Winde zu verstreuen. Ähnlich dreht die Lichtwelle an der Innenseite der Kugel viele Runden und kommt binnen kürzester Zeit Tausende Male am Golddrähtchen vorbei. Dadurch verstärkt sich die Wechselwirkung mit dem Drähtchen.
Das Nanodrähtchen zieht das aus der Kugel lappende Licht weiter heraus. So entsteht am Nanodrähtchen ein gebündelter Lichtfleck, der in etwa dessen Maße hat, also nur wenige Nanometer klein ist. Bindet nun ein Enzym oder ein Molekül an das Golddrähtchen wird es in den Lichtfleck getaucht. Der Sensor zeichnet dann verschiedene Signale auf, je nachdem welches Molekül sich im Lichtfleck aufhält und wie es sich darin bewegt. So können auch die Bewegungen eines einzelnen Enzyms abgetastet und aufgezeichnet werden.
Unterschiedliche Signale für verschiedene Enzymformen
Die Technik beruht im Kern auf der sogenannten Plasmonik. Angewendet auf winzige Metallstrukturen wie eben die Nanodrähtchen ermöglicht die Plasmonik eine Bündelung von Licht auf wenige Nanometer. „Auf diese Weise können wir das Licht auf die Größe des Enzyms herunterskalieren“, sagt Frank Vollmer vom Max-Planck-Institut für die Physik des Lichtes in Erlangen. Und sogar noch weiter, denn auch einzelne Ionen haben die Erlanger Forscher mit ihrer Methode ins Visier genommen.
In einem ihrer Versuche haben die Physiker das Enzym DNA-Polymerase an ihren Sensor geheftet, um dessen Bewegungen aufzuzeichnen. Diese ähneln denen einer greifenden Hand: Die Polymerase greift nach dem DNA-Strang, um ihn zu bearbeiten. Die geöffnete Molekülhand erzeugte ein anderes Signal als die geschlossene, weil sich die Größe des Überlapps zwischen dem Lichtfleck und dem Enzym verändert. Daher konnten die Forscher in Echtzeit aufzeichnen, wie sich das Enzym öffnet und schließt. „Mit einer Weiterentwicklung unserer Methode könnte man sogar die Synthese eines DNA-Stranges durch die Polymerase direkt aufzeichnen“, nennt Vollmer ein Beispiel. Biochemiker könnten dann in Echtzeit beobachten, wie das Enzym die genetische Information kopiert, und aus dem Signal des Nanosensors sogar die genaue Abfolge der Buchstaben des genetischen Codes ablesen.
In einem passenden Experiment, liefert die neue Methode auch Erkenntnisse, die über die bloße Beobachtung von Enzymbewegungen hinausgehen: „Wir haben damit die Temperaturabhängigkeit der Enzymaktivität beobachtet“, sagt Frank Vollmer. So ließen sich leicht thermodynamische Untersuchungen durchführen, die zum Beispiel Aufschluss über die Aktivierungsenergie eines Enzyms geben, erklärt der Physiker. Die Aktivierungsenergie ist ein Maß dafür, wie effizient ein solcher Biokatalysator arbeitet.
Mit dem Nanosensor lassen sich chemische Reaktionen beobachten
Um zu demonstrieren, wie klein die Teilchen sein können, die sich mit dem plasmonischen Nanosensor detektieren lassen, beobachteten die Erlanger Forscher damit auch einzelne Ionen, also elektrisch geladene Atome. „Es hat uns überrascht, dass das überhaupt geht“, sagt Vollmer. Die Zink- und Quecksilber-Ionen messen nur rund einen zehntel Nanometer, weniger als ein Tausendstel der Lichtwellenlänge. An der Spitze eines Nanodrähtchens lässt sich aber ein Lichtfleck erzeugen, der auch für solche Dimensionen klein genug ist. „Es geht hier nicht um den Nachweis einzelner Ionen“, betont Vollmer. Dass sich genau ein Ion an die Spitze des Nanodrähtchens heftete, kontrollierten die Forscher über die Konzentration der Ionen in einer Lösung. Mit einer solchen Anordnung könnten Biologen auch die Funktion von Ionenkanälen untersuchen. Solche Proteine sind etwa in die Membranen von Nervenzellen eingebettet, um elektrische reize durch die Nervenbahnen zu leiten.
Der Nanosensor, den Frank Vollmers Team entwickelt hat kann aber nicht nur biochemische Prozesse sichtbar machen, bei denen Proteine und Enzymen mitmischen, sondern auch Reaktionen der synthetischen Chemie. So gelang es den Forschern, chemische Reaktionen von einzelnen Molekülen mit der Oberfläche des Goldnanodrähtchens zu beobachten. „So kann man beispielsweise Interaktionsmechanismen detektieren und analysieren“, sagt Frank Vollmer. Deren zeitlicher Ablauf könne beispielsweise Aufschluss über das Bindungsverhalten unterschiedlicher Moleküle an der Goldoberfläche des Nanodrähtchens liefern.
Um das zu zeigen untersuchten die Erlanger Wissenschaftler zwei Arten von Molekülen: die einen besaßen eine so genannte Amin-Gruppe, die andere eine Thiol-Gruppe. „Es stellte sich heraus, dass die beiden Gruppen in zwei verschiedenen Mechanismen mit der Goldoberfläche reagieren“, erklärt Vollmer. Während die Amine sich nur mit aus der Oberfläche hervorstehenden Goldatomen verbinden, heften sich die Thiole nur an die Atome, die voll in der Oberfläche eingebettet sind.
Reaktionsbedingungen testen und otimieren
Auch Reaktionen zwischen den verschiedenen Molekülen verfolgen die Forscher. „Die Reaktionsbedingungen können Chemiker so in Echtzeit testen und optimieren“, sagt Vollmer. Reaktionen lassen sich mit dem Lichtfleck an dem Golddrähtchen aber nicht nur untersuchen, sondern bis zu einem gewissen Grad auch steuern. So haben es die Erlanger Forscher durch eine Erhöhung der Lichtintensität im gebündelten Lichtfleck einem Quecksilber-Ion ermöglicht, an die Goldoberfläche des Nanodrahtes zu binden. Denn durch die hohe Lichtintensitaet im Lichtfleck erhöht sich die Energie von Elektronen im Golddrähtchen, die eine Reaktion mit den Quecksilber-Ionen eingehen können. Auf diese Weise entsteht ein stabiles Amalgam zwischen Gold und Quecksilber. Und die Amalgam-Verbindung der Elemente hält dann auch, wenn der Lichtfleck wegfällt, da eine relativ feste kovalente Bindung zwischen einem Gold und einem Quecksilber Atom entstanden ist.
„Die Steuerung von Reaktionen und Enyzmaktivitäten auf dem plasmonischen Biosensor sind ein sehr interessantes zukünftiges Forschungsfeld“, sagt Vollmer. Dabei ließe sich das Lichtfeld darüber hinaus als optische Pinzette einsetzen, um einzelne Biomoleküle zur optischen Analyse am Sensor voruebergehend festzuhalten.
Erkenntnisse, warum die Maschinerie des Lebens ins Stocken gerät
Für die Zukunft verfolgt Vollmers Team die Vision, Moleküle, Atom für Atom regelrecht zu scannen, und zwar sowohl Biomoleküle als auch synthetische Moleküle: „Wenn wir verschiedene Lichtquellen mit unterschiedlichen Wellenlängen und Polarisationen einsetzen, ist es prinzipiell möglich, den Überlapp des Lichtes mit dem Molekül zu ändern, und verschiedene Volumen desselben Moleküls regelrecht abzutasten“, sagt Vollmer. Mit einem solchen molekularen Scanner ließe sich der gleiche Prozess gewissermaßen aus verschiedenen Blickwinkeln und in sehr kurzen zeitlichen Abständen zu betrachten. Eine höher aufgelöste Abbildung des Prozesses würde das Verständnis der molekularen Maschinerie deutlich erhöhen. Biologen könnten dann sogar sehr detailliert beobachten, wie sich Strukturen ändern, und zwar über Zeitspannen von Nanosekunden bis hin zu mehreren Stunden. Zudem wird mit dem plasmonischen Biosensor die Idee eines automatisierten Labors greifbar, das nicht größer als ein Fingernagel ist und eine Probe Protein für Protein abtastet, um Krankheiten auf molekularer Ebene diagnostiziert.
Wenn sich mit dem plasmonischen Nanosensor künftig verfolgen lässt, wie Enzyme ihre Gestalt wechseln, verstehen Mediziner in einigen Fällen möglicherweise auch besser, warum die Maschinerie des Lebens ins Stocken gerät und ein Organismus krank wird. Denn manche Krankheiten, wie etwa Alzheimer, hängen damit zusammen, dass sich die Struktur von Proteinen verändert. Genauere Einsichten in solche Prozesse könnten dann sogar Ansatzpunkte für neue Therapien liefern.
Originalveröffentlichung
Eugene Kim, Martin Dieter Baaske, Isabel Schuldes, Peter Wilsch, Frank und Vollmer; "Label-free optical detection of single enzyme-reactant reactions and associated conformational changes"; Science Advances
Martin Dieter Baaske und Frank Vollmer; "Optical observation of single atomic ions interacting with plasmonic nanorods in aqueous solution"; Nature Photonics
Eugene Kim, Martin Dieter Baaske und Frank Vollmer; "In Situ Observation of Single-Molecule Surface Reactions from Low to High Affinities"; Advanced Materials
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Sensortechnik
Die Sensortechnik hat die chemische Industrie revolutioniert, indem sie präzise, zeitnahe und zuverlässige Datenbereitstellung in einer Vielzahl von Prozessen ermöglicht. Vom Überwachen kritischer Parameter in Produktionslinien bis hin zur Früherkennung potenzieller Störungen oder Gefahren – Sensoren sind die stillen Wächter, die Qualität, Effizienz und Sicherheit gewährleisten.

Themenwelt Sensortechnik
Die Sensortechnik hat die chemische Industrie revolutioniert, indem sie präzise, zeitnahe und zuverlässige Datenbereitstellung in einer Vielzahl von Prozessen ermöglicht. Vom Überwachen kritischer Parameter in Produktionslinien bis hin zur Früherkennung potenzieller Störungen oder Gefahren – Sensoren sind die stillen Wächter, die Qualität, Effizienz und Sicherheit gewährleisten.