Die molekularen Mechanismen der circadianen Uhr aufgedeckt
Nobelpreise für Physiologie oder Medizin bekannt gegeben
Das Leben auf der Erde ist der Rotation unseres Planeten angepasst. Seit vielen Jahren wissen wir, dass lebende Organismen, einschließlich des Menschen, eine innere, biologische Uhr haben, die ihnen hilft, den normalen Tagesrhythmus vorauszusehen und sich dementsprechend anzupassen. Aber wie funktioniert diese Uhr eigentlich? Jeffrey C. Hall, Michael Rosbash und Michael W. Young konnten in unsere biologische Uhr hineinschauen und ihr Innenleben erklären. Ihre Entdeckungen erklären, wie Pflanzen, Tiere und Menschen ihren biologischen Rhythmus so anpassen, dass er mit den Erdrevolutionen synchronisiert wird.
Die Nobelpreisträger haben mit Fruchtfliegen als Modellorganismus ein Gen isoliert, das den normalen biologischen Tagesrhythmus steuert. Sie zeigten, dass dieses Gen für ein Protein kodiert, das sich nachts in der Zelle anreichert und tagsüber abgebaut wird. Anschließend identifizierten sie weitere Eiweißbestandteile dieser Maschine und entlarvten den Mechanismus, der das selbsttragende Uhrwerk im Inneren der Zelle steuert. Wir erkennen jetzt, dass biologische Uhren nach den gleichen Prinzipien in Zellen anderer mehrzelliger Organismen, einschließlich des Menschen, funktionieren.
Mit höchster Präzision passt sich unsere innere Uhr unserer Physiologie an die dramatisch unterschiedlichen Phasen des Tages an. Die Uhr regelt kritische Funktionen wie Verhalten, Hormonspiegel, Schlaf, Körpertemperatur und Stoffwechsel. Unser Wohlbefinden wird beeinträchtigt, wenn es eine vorübergehende Diskrepanz zwischen unserer äußeren Umgebung und dieser inneren biologischen Uhr gibt, zum Beispiel wenn wir über mehrere Zeitzonen reisen und "Jetlag" erleben. Es gibt auch Anzeichen dafür, dass ein chronischer Versatz zwischen unserem Lebensstil und dem Rhythmus, den unser innerer Zeitnehmer diktiert, mit einem erhöhten Risiko für verschiedene Krankheiten verbunden ist.
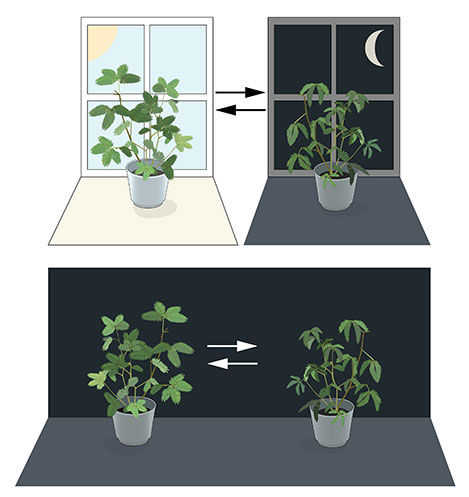
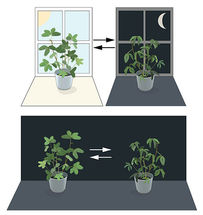
Abbildung 1. Eine innere biologische Uhr. Die Blätter der Mimosenpflanze öffnen sich tagsüber zur Sonne hin, schließen sich aber in der Dämmerung (oberer Teil). Jean Jacques d' Ortous de Mairan stellte die Pflanze in ständiger Dunkelheit (unterer Teil) auf und stellte fest, dass die Blätter weiterhin ihrem normalen Tagesrhythmus folgen, auch ohne jegliche Schwankungen im Tageslicht.
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
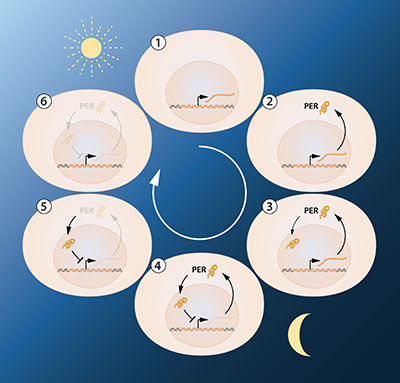
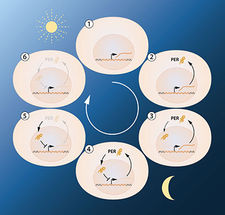
Abbildung 2A. Eine vereinfachte Darstellung der Feedback-Regulation des Periodengens. Die Abbildung zeigt die Abfolge der Ereignisse während einer 24h-Oszillation. Wenn das Periodengen aktiv ist, wird die Periode mRNA gebildet. Die mRNA wird zum Zytoplasma der Zelle transportiert und dient als Template für die Produktion des PER-Proteins. Das PER-Protein sammelt sich im Zellkern an, wo die Genaktivität blockiert wird. Daraus ergibt sich der hemmende Feedback-Mechanismus, der einem circadianen Rhythmus zugrunde liegt.
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
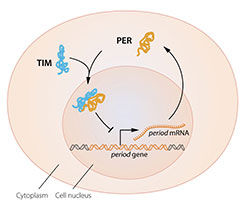
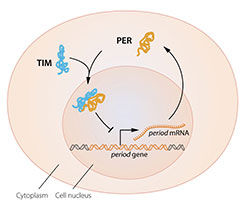
Abbildung 2B. Eine vereinfachte Darstellung der molekularen Bestandteile der circadianen Uhr.
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
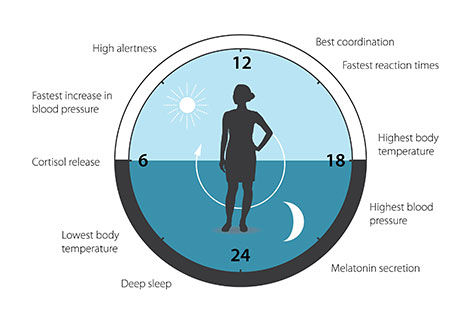
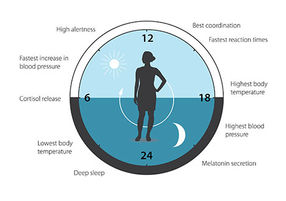
Abbildung 3. Die circadiane Uhr antizipiert und passt unsere Physiologie den verschiedenen Tagesphasen an. Unsere biologische Uhr hilft bei der Regulierung von Schlafverhalten, Fütterungsverhalten, Hormonausschüttung, Blutdruck und Körpertemperatur.
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
Unsere innere Uhr
Die meisten lebenden Organismen antizipieren und passen sich den täglichen Veränderungen in der Umwelt an. Im 18. Jahrhundert studierte der Astronom Jean Jacques d' Ortous de Mairan Mimosenpflanzen und stellte fest, dass sich die Blätter tagsüber zur Sonne hin öffneten und in der Abenddämmerung schlossen. Er fragte sich, was passieren würde, wenn die Pflanze in ständiger Dunkelheit stehen würde. Er fand heraus, dass die Blätter unabhängig von der täglichen Sonneneinstrahlung ihren normalen täglichen Schwingungen folgten (Abbildung 1). Pflanzen schienen ihre eigene biologische Uhr zu haben.
Andere Forscher fanden heraus, dass nicht nur Pflanzen, sondern auch Tiere und Menschen eine biologische Uhr haben, die unsere Physiologie auf die Schwankungen des Tages vorbereiten hilft. Diese regelmäßige Adaption wird als zirkadianer Rhythmus bezeichnet, der aus den lateinischen Wörtern circa bedeutet "um" und stirbt im Sinne von Tag "stammt. Aber wie unsere innere biologische zirkadiane Uhr funktioniert, blieb ein Rätsel.
Identifizierung eines Uhrengens
In den 1970er Jahren fragten Seymour Benzer und sein Schüler Ronald Konopka, ob es möglich sei, Gene zu identifizieren, die den circadianen Rhythmus in Fruchtfliegen steuern. Sie zeigten, dass Mutationen in einem unbekannten Gen die zirkadiane Uhr der Fliegen störten. Sie haben diese Genperiode benannt. Aber wie kann dieses Gen den circadianen Rhythmus beeinflussen?
Die diesjährigen Nobelpreisträger, die auch Fruchtfliegen studierten, wollten herausfinden, wie die Uhr funktioniert. 1984 gelang es Jeffrey Hall und Michael Rosbash, die in enger Zusammenarbeit an der Brandeis University in Boston und Michael Young an der Rockefeller University in New York zusammenarbeiteten, das Gen der Periode zu isolieren. Jeffrey Hall und Michael Rosbash entdeckten dann, dass sich das PER, das Protein, das für die Periode kodiert wurde, während der Nacht akkumuliert und tagsüber abgebaut wurde. So schwingen die PER-Proteinwerte über einen 24-Stunden-Zyklus, synchron zum circadianen Rhythmus.
Selbstregulierendes Uhrwerk
Das nächste Hauptziel war es zu verstehen, wie solche zirkadianen Schwingungen erzeugt und aufrechterhalten werden können. Jeffrey Hall und Michael Rosbash hypothesized, dass das PER-Protein die Aktivität des periodischen Gens blockierte. Sie folgerten, dass PER-Proteine durch eine hemmende Rückkopplungsschleife die eigene Synthese verhindern und dadurch ihren eigenen Spiegel in einem kontinuierlichen, zyklischen Rhythmus regulieren könnten (Abbildung 2A).
Das Modell war verlockend, aber es fehlten einige Teile des Puzzles. Um die Aktivität des periodischen Gens zu blockieren, müsste das im Zytoplasma produzierte PER-Protein den Zellkern erreichen, wo sich das Erbgut befindet. Jeffrey Hall und Michael Rosbash hatten gezeigt, dass sich PER-Protein nachts im Zellkern anreichert, aber wie kam es dorthin? 1994 entdeckte Michael Young ein zweites, zeitloses Uhrengen, das für das TIM-Protein kodiert, das für einen normalen circadianen Rhythmus benötigt wurde. In eleganter Arbeit zeigte er, dass die beiden Proteine, wenn TIM an PER gebunden, in den Zellkern eindringen konnten, wo sie die Genaktivität blockierten, um die hemmende Rückkopplungsschleife zu schließen (Abbildung 2B).
Solch ein Regelungs-Feedback-Mechanismus erklärte, wie diese Schwingung der zellulären Proteinniveaus auftauchte, aber Fragen blieben. Wie wurde die Frequenz der Schwingungen gesteuert? Michael Young identifizierte noch ein weiteres Gen, Doubletime, das für das DBT-Protein kodiert, das die Akkumulation des PER-Proteins verzögerte. So konnte man sehen, wie eine Schwingung genauer auf einen 24-Stunden-Zyklus eingestellt wird.
Die Paradigmenwechselentdeckungen der Preisträger begründeten die wichtigsten mechanistischen Prinzipien der biologischen Uhr. In den folgenden Jahren wurden weitere molekulare Komponenten des Uhrwerks aufgeklärt und seine Stabilität und Funktion erklärt. So identifizierten die Preisträger in diesem Jahr zusätzliche Proteine, die für die Aktivierung des Periodengens sowie für den Mechanismus, mit dem Licht die Uhr synchronisieren kann, benötigt werden.
Zeit für unsere menschliche Physiologie
Die biologische Uhr ist an vielen Aspekten unserer komplexen Physiologie beteiligt. Wir wissen jetzt, dass alle mehrzelligen Organismen, einschließlich des Menschen, einen ähnlichen Mechanismus zur Steuerung der circadianen Rhythmen nutzen. Ein großer Teil unserer Gene wird durch die biologische Uhr reguliert, so dass ein sorgfältig kalibrierter circadianer Rhythmus unsere Physiologie an die verschiedenen Tagesphasen anpasst (Abbildung 3). Seit den bahnbrechenden Entdeckungen der drei Preisträger hat sich die circadiane Biologie zu einem riesigen und hochdynamischen Forschungsfeld entwickelt, das Auswirkungen auf unsere Gesundheit und unser Wohlbefinden hat.
Originalveröffentlichung
Zehring, W.A., Wheeler, D.A., Reddy, P., Konopka, R.J., Kyriacou, C.P., Rosbash, M., and Hall, J.C.; "P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster"; Cell; 1984
Bargiello, T.A., Jackson, F.R., and Young, M.W.; "Restoration of circadian behavioural rhythms by gene transfer in Drosophila"; Nature; 1984
Siwicki, K.K., Eastman, C., Petersen, G., Rosbash, M., and Hall, J.C.; "Antibodies to the period gene product of Drosophila reveal diverse tissue distribution and rhythmic changes in the visual system"; Neuron; 1988
Hardin, P.E., Hall, J.C., and Rosbash, M.; "Feedback of the Drosophila period gene product on circadian cycling of its messenger RNA levels"; Nature; 1990
Liu, X., Zwiebel, L.J., Hinton, D., Benzer, S., Hall, J.C., and Rosbash, M.; "The period gene encodes a predominantly nuclear protein in adult Drosophila"; J Neurosci; 1992
Vosshall, L.B., Price, J.L., Sehgal, A., Saez, L., and Young, M.W.; "Block in nuclear localization of period protein by a second clock mutation, timeless"; Science; 1994
Price, J.L., Blau, J., Rothenfluh, A., Abodeely, M., Kloss, B., and Young, M.W.; "double-time is a novel Drosophila clock gene that regulates PERIOD protein accumulation"; Cell; 1998






























































