Potenzial für eine grüne Wasserstoff-Wirtschaft
Erstmalige Charakterisierung einer sensorischen [FeFe] Hydrogenase gelungen
Hydrogenasen sind Enzyme, die in der Lage sind, Wasserstoffgas (H2) aus Protonen im wässrigen Milieu zu erzeugen. Eine Reaktion, die eine große Relevanz für eine potentielle zukünftige grüne Wasserstoffwirtschaft birgt.
Max-Planck-Institut für Chemische Energiekonversion
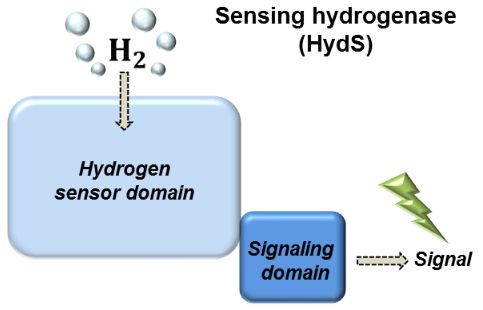
Bakterien, die diese Enzyme enthalten, produzieren H2 häufig als Abfallprodukt ihres Zucker-basierten Metabolismus in Abwesenheit von Sauerstoff. Andere Bakterien können den Wasserstoff als Energiequelle nutzen. Hydrogenasen, die Schlüsselenzyme in beiden Prozessen sind nur unter speziellen Bedingungen erforderlich, d.h. ihre Synthese in dem Bakterium muss der Anwesenheit und Konzentration von H2 angepasst werden. Diese Regulation wird durch sogenannte sensorische oder regulatorische Hydrogenasen erreicht, die in der Lage sind, selbst kleinste Mengen von H2 im Medium zu detektieren und diese Information an die Protein-Synthesemaschinerie (für katalytische Hydrogenasen) weiterzuleiten.
Bis heute hat sich eine Klasse von Sensor-Hydrogenasen der Charakterisierung komplett entzogen, nämlich die der wichtigen [FeFe]-Hydrogenasen (HydS). Jetzt ist es einem Team von Wissenschaftlern am Max-Planck-Institut für Chemische Ernergiekonversion in Mülheim an der Ruhr und dem Institute of Low Temperature Science an der University of Hokkaido (Japan) gelungen, HydS aus dem thermophilen Bakterium Thermotoga maritima herzustellen und zu charakterisieren. Dieser Erfolg basiert auf der kürzlich entwickelten Technik der künstlichen Maturierung des Enzyms (Esselborn et al. Nat. Chem. Biol. 2013), sowie dem Einsatz moderner spektroskopischer Methoden, die zeigten wie das Protein das katalytische Zentrum in eleganter Weise feinabstimmt und es dadurch für seine sensorische Funktion optimiert.
Die Wissenschaftler zeigen, dass das katalytische Zentrum sehr empfindlich auch kleinste Mengen H2 detektiert, was dem Bakterium eine sehr effektive Signalübertragung erlaubt. Diese Ergebnisse stellen einen wesentlichen Schritt im Verständnis der Funktion der sensorischen Hydrogenasen dar. Die Kenntnis der Änderungen der Aminosäureumgebung im Sensor im Vergleich zu den katalytischen [FeFe]-Hydrogenasen ist ein wichtiges Element für das tiefere Verständnis dieser Wasserstoff-umsetzenden bzw. -erzeugenden Proteine. Die umfassende Entschlüsselung des Mechanismus der Hydrogenasen bietet die Grundlage, um bessere bioinspirierte Katalysatoren für den Einsatz in Brennstoffzellen und Wasserelektrolyseuren zu entwickeln. Ein wichtiger Schritt auf dem Weg zu einer Energiewirtschaft, die auf Wasserstoff als Energieträger basiert.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Nipa Chongdar, James A. Birrell, Krzysztof Pawlak, Constanze Sommer, Edward J. Reijerse, Olaf Rüdiger, Wolfgang Lubitz, Hideaki Ogata; "Unique spectroscopic properties of the H-cluster in a putative sensory [FeFe] hydrogenase"; Journal of the American Chemical Society; 2017
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Chemie-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Universität Paderborn: Chemiker beweisen erstmals, dass Nutzpflanzen Antibiotika aus güllegedüngten Böden aufnehmen

Friedrich Theysohn GmbH - Salzgitter, Deutschland
NRW plant landesweiten Cluster zur industriellen Biotechnologie - Chemieunternehmen Degussa, Bayer und Henkel übernehmen Themenfindung
European Materials Research Society (E-MRS) - Straßburg, Frankreich
Bundesvereinigung Materialwissenschaft und Werkstofftechnik (BV MatWerk) - Berlin, Deutschland

CurTec Deutschland GmbH - Düsseldorf, Deutschland

Nuova Defim Spa - Alzate Brianza, Italien

Den Regen für Hydrovoltaik nutzen






























































