Bindungsfähiger als erwartet: Wasserstoff-Atome haften ultrakurz auf Graphen
Graphen wird als außergewöhnlicher Werkstoff gefeiert. Es besteht aus reinem Kohlenstoff und ist nur eine einzige Atomlage dünn. Dennoch ist es enorm stabil und sogar leitfähig. Für die Elektronik allerdings hat Graphen entscheidende Nachteile: Denn noch ist es nicht als Halbleiter einsetzbar. Wasserstoff-Atome auf Graphen könnten dies ändern. Forscher aus Göttingen und Pasadena (USA) haben jetzt sichtbar gemacht, wie Wasserstoff-Atome an Kohlenstoff-Atomen von Graphen chemisch binden und was dabei passiert.
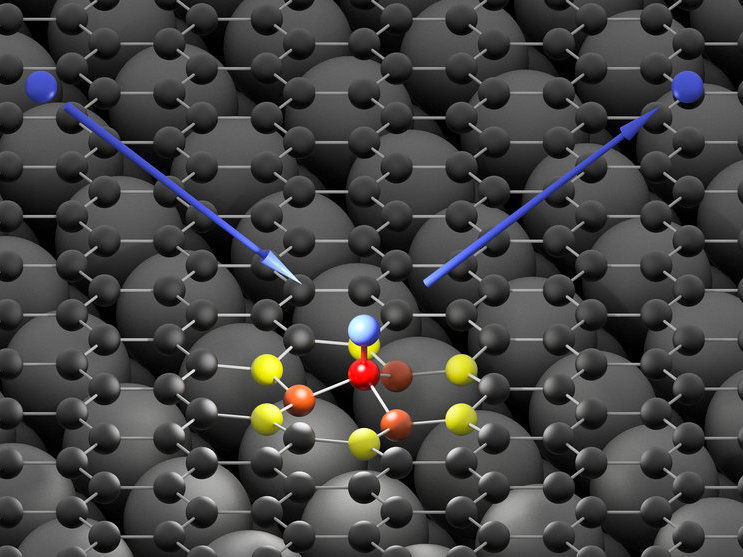
Das Wasserstoff-Atom (blau) trifft auf die Graphen-Oberfläche (schwarz) und geht eine ultraschnelle Bindung mit einem Kohlenstoff-Atom (rot) ein. Die hohe Energie des auftreffenden Wasserstoff-Atoms nehmen erst benachbarte Kohlenstoffatome (orange und gelb) auf und geben sie dann in Form einer Schallwelle an die Graphene-Oberfläche weiter.
© Oliver Bünermann / Max Planck Institute for Biophysical Chemistry & University of Göttingen
Das internationale Forscherteam hat dazu Wasserstoff-Atome auf eine Graphenschicht aufprallen lassen. „Das Wasserstoff-Atom hat sich allerdings anders verhalten, als wir erwartet hatten“, erzählt Alec Wodtke, Leiter der Abteilung Dynamik an Oberflächen am Max-Planck-Institut (MPI) für biophysikalische Chemie und Professor am Institut für Physikalische Chemie an der Universität Göttingen. „Statt sofort wieder davonzufliegen, bleiben die Wasserstoff-Atome kurz an den Kohlenstoff-Atomen ‚kleben‘ und prallen erst dann von der Oberfläche ab. Sie bilden eine ultraschnelle chemische Bindung“, berichtet Wodtke. Und noch etwas hatte die Wissenschaftler überrascht: Die Wasserstoff-Atome haben eine Menge Energie, bevor sie auf das Graphen auftreffen, aber nicht mehr viel, wenn sie davonfliegen. Wasserstoff-Atome verlieren beim Aufprall also den Großteil ihrer Energie, doch wohin geht diese?
Nur zehn Billiardstel einer Sekunde gebunden
Um die überraschenden experimentellen Beobachtungen zu erklären, entwickelte der Göttinger MPI-Forscher Alexander Kandratsenka in Kooperation mit Kollegen vom California Institute of Technology theoretische Methoden, die sie am Computer simulieren und mit ihrem Experiment vergleichen konnten. Erst durch Kombination von Experiment und Theorie konnten sie schließlich die ultraschnellen Bewegungen bei der chemischen Bindung verfolgen. „Diese Bindung hält nur etwa zehn Femtosekunden – das sind zehn Billiardstel einer Sekunde. Damit ist sie einer der schnellsten chemischen Bindungen, die je direkt beobachtet werden konnte“, erläutert Alexander Kandratsenka.
Schwingendes Graphen erleichtert Bindung
„In diesen rund zehn Femtosekunden kann das Wasserstoff-Atom fast seine ganze Energie an das Graphen abgeben und löst dort eine Schallwelle aus, die sich vom Eintreffpunkt kreisförmig über die Graphen-Oberfläche ausbreitet, ganz ähnlich wie ein Stein, der ins Wasser fällt und eine Welle auslöst“, so Kandratsenka. Die Schallwelle trägt dazu bei, dass das Wasserstoff-Atom leichter an das Kohlenstoff-Atom binden kann, als die Forscher erwartet und bisherige Modelle vorhergesagt hatten.
Die Ergebnisse des Wissenschaftlerteams liefern fundamental neue Einsichten über chemische Bindungen. Und sie sind auch für die Industrie interessant. Bekannt ist nämlich: Wasserstoff-Atome verändern Graphen so, dass es von einem elektrischen Leiter zu einem Halbleiter wird –und damit wäre es in der Elektronik vielseitiger einsetzbar.
Der Aufwand, diese Versuche durchzuführen, sei enorm gewesen, verrät Oliver Bünermann, Projektgruppenleiter an der Universität Göttingen. „Denn wir mussten diese im Ultra-Hochvakuum durchführen, um die Graphen-Oberfläche perfekt sauber zu halten.“ Zum Einsatz kam zudem eine Vielzahl von Lasersystemen, um die Wasserstoff-Atome vor dem Experiment zu präparieren und sie nach dem Aufprall nachzuweisen. Die Experimente komplett in Göttingen zu realisieren, sei nicht zuletzt dank der ausgezeichneten technischen Mitarbeiter in den Werkstätten am MPI für biophysikalische Chemie und an der Universität Göttingen gelungen, so Bünermann.