Ist die einfachste chemische Reaktion wirklich so einfach?
Unentdeckter Mechanismus führt zu einer deutlichen Quanteninterferenz und beweist, dass die Natur "würfelt"
Die meisten Menschen denken, dass die Quantentheorie, die die Bewegung von Molekülen und atomaren und subatomaren Teilchen beschreibt, nicht intuitiv ist, da die Quantenmechanik ein Verhalten beschreibt, das im Widerspruch zur klassischen Mechanik steht. Sogar Albert Einstein, der die Quantenmechanik nie akzeptiert hat, sagte berühmterweise, dass "er (Gott oder die Natur) nicht würfelt" - was bedeutet, dass die Gesetze der Physik sich nicht der Unsicherheit oder dem Zufall unterwerfen, wie es die Quantentheorie impliziert.
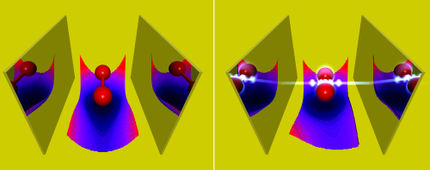
Schematische Darstellung der beiden topologischen Pfade in der H + HD- bis H2 + D-Reaktion: der Pfad der direkten Abstraktionsreaktion (gegen den Uhrzeigersinn) und der Pfad der wandernden Einfügungsreaktion (im Uhrzeigersinn).
DICP
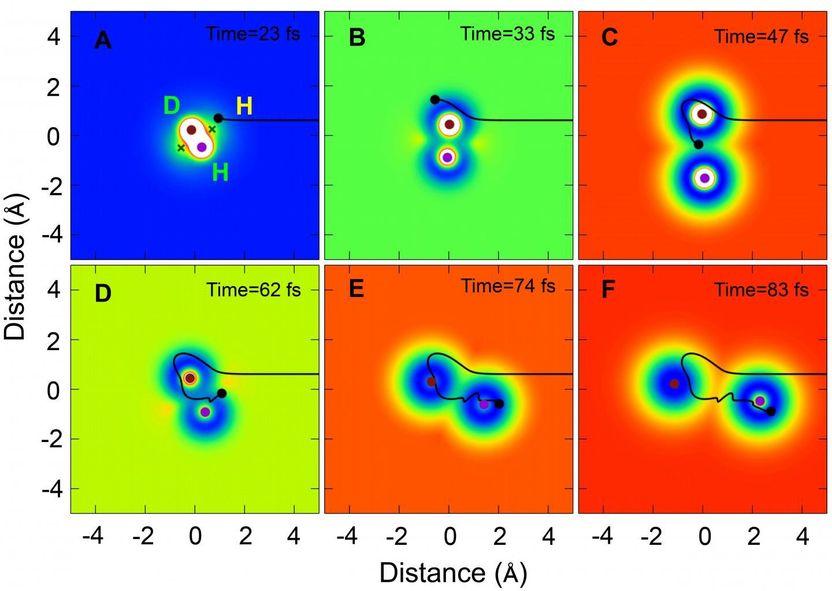
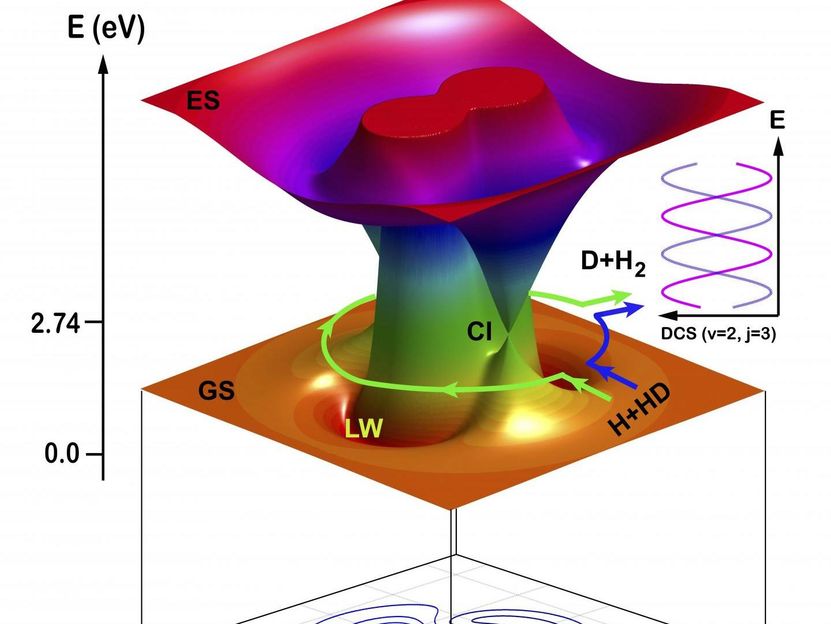
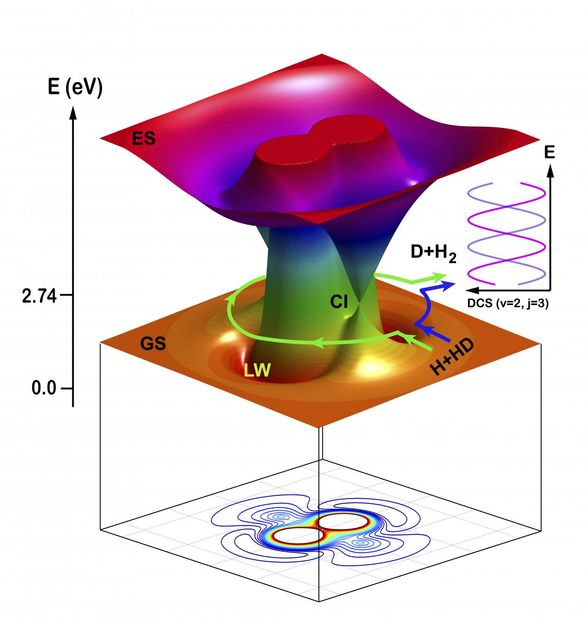
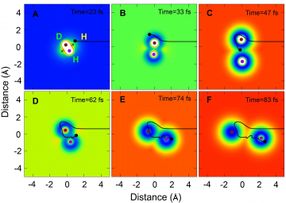
Eine repräsentative Trajektorie der H+HD- bis H2+D-Reaktion in einem bestimmten Streuwinkel (rückwärts streuende Richtung) über den Roaming-Mechanismus, der sich mit der Zeit in kartesischen Koordinaten bewegt.
DICP
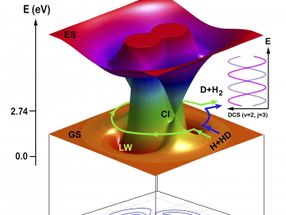
Eine chemische Reaktion verläuft manchmal auf merkwürdige Weise, da der Verlauf einer Reaktion in mikroskopischer Sicht von der Quantentheorie bestimmt wird.
Neue Forschungen von Wissenschaftlern des Dalian Institute of Chemical Physics (DICP) der Chinesischen Akademie der Wissenschaften (CAS) haben überraschenderweise gezeigt, dass es bei der einfachsten, gut untersuchten Reaktion immer noch einen unentdeckten Mechanismus gibt. Er führt zu einer deutlichen Quanteninterferenz und beweist erneut, dass die Natur "würfelt".
Die fragliche Reaktion ist H + HD → H2 + D. In der Studie, die am 15. Mai in Science veröffentlicht wurde, wurden Gruppen unter der Leitung von Profs. YANG Xueming, ZHANG Donghui, SUN Zhigang und XIAO Chunlei vom DICP eine neue Art der Quanteninterferenz in dieser einfachen Reaktion entdeckt.
In der Physik ist Interferenz die Kombination von zwei oder mehr Wellenformen zu einer resultierenden Welle, bei der die Verschiebung entweder verstärkt oder aufgehoben wird. Quanteninterferenz kann zwischen Teilchen auftreten, die an der gleichen Position oder im gleichen Quantenzustand, aber auf unterschiedlichen Wegen ankommen.
Da eine chemische Reaktion im Wesentlichen ein Kollisions- und Streuprozess ist, an dem Atome und/oder Moleküle beteiligt sind, können wir erwarten, dass bei einer chemischen Reaktion Interferenzphänomene auftreten.
Unter allen chemischen Reaktionen sind die H + H2-Reaktion und ihre Isotopologen die einfachsten. An dieser Reaktion sind nur drei Elektronen beteiligt; daher ist es bequem, sich mit genauer Quantenchemie zu befassen, um die Wechselwirkungsenergie zu berechnen, an der die drei Atome beteiligt sind.
Im vergangenen Jahr fanden die DICP-Forscher starke und regelmäßige Schwingungen als Funktion der Energie bei einem bestimmten Streuwinkel des Produkts H2 während der H + HD-Reaktion in bestimmten Schwingungszuständen.
Tatsächlich wurden ähnliche Schwingungen bei anderen Reaktionen beobachtet, aber sie sind nicht so regelmäßig wie bei der H+HD-Reaktion. Der physikalische Ursprung solcher Oszillationen bleibt unklar.
Um dieses interessante Phänomen zu verstehen, führten die Forscher eine kombinierte theoretische und experimentelle Untersuchung der H+HD-Reaktion durch.
Experimentell zeichneten sie durch Verbesserung der Apparatur mit gekreuzten Molekularstrahlen reaktive Streusignale unter einem bestimmten Streuwinkel als Funktion der relativ hohen Energie auf.
Sie entwickelten die Methoden der Quantendynamik weiter, indem sie die topologische Theorie anwandten, um die Wege zu analysieren, auf denen die Reaktion abläuft. Die topologische Theorie zeigte, dass die beobachteten regelmäßigen Schwingungen aus Interferenzen zwischen Produkten resultierten, die über zwei verschiedene Pfade erzeugt wurden.
Die Forscher analysierten die Mechanismen der Reaktionsdynamik mit Hilfe der quasi-klassischen Trajektorien-Theorie (QCT). Die Ergebnisse zeigten, dass die Reaktion über einen einzigen Pfad verlief, wobei der traditionelle direkte Extraktionsmechanismus verwendet wurde, d.h. das ankommende H-Atom kollidierte mit dem H-Atom im diatomaren Reaktanten HD-Molekül und extrahierte es, um eine neue chemische Bindung von H2 zu bilden.
Die Reaktion verlief auch über einen anderen Weg unter Verwendung eines neuen Roaming-Mechanismus. Die Momentaufnahmen aus der QCT-Theorie für den Roaming-Mechanismus zeigen, dass sich das ankommende H-Atom zunächst über den konischen Schnittbereich (Cl) dem HD-Molekül in Richtung des D-Atom-Endes näherte und dann in HD um das D-Atom herumwanderte. Als sich das ankommende H-Atom der CI-Region näherte, begann sich die HD-Bindung zu dehnen, wodurch es dem umherwandernden H-Atom möglich wurde, sich in das gedehnte HD-Molekül einzufügen. Das ankommende H-Atom bildete dann eine neue chemische Bindung mit dem H-Atom in HD.
Die Produkte (H2) aus diesen beiden Bahnen wurden in denselben Streuwinkel gestreut, in dem die Quanteninterferenz auftrat.
Darüber hinaus ist die Wahrscheinlichkeit, dass ein solch ungewöhnlicher Roaming-Mechanismus auftritt, recht gering - nur etwa 0,3% aller Reaktionen.
Diese Arbeit zeigt einmal mehr die Quantennatur einer chemischen Reaktion auf mikroskopischer Ebene. Sie zeigt auch, dass chemische Reaktionen kompliziert sind.
Selbst die einfache Reaktion H + HD → H2 + D, die seit Jahrzehnten untersucht wird, hat eine geringe Wahrscheinlichkeit, dass sie unerwartete Mechanismen einsetzt.
Im Leben werden viele große Ereignisse durch Ereignisse mit geringer Wahrscheinlichkeit ausgelöst. Wer kann garantieren, dass ein Reaktionsmechanismus von so geringer Wahrscheinlichkeit nicht zu überraschenden Ergebnissen führt?
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.