Experiment zeigt erstmals im Detail, wie Elektrolyte metallisch werden
Der Übergang in den Zustand zeigt sich durch einen Farbwechsel von blau zu gold
Ein internationales Team hat erstmals an BESSY II ein raffiniertes Experiment entwickelt, um die Bildung eines metallischen Leitungsbandes in Elektrolyten zu beobachten. Dafür stellten sie kryogene Lösungen aus flüssigem Ammoniak mit verschiedenen Konzentrationen von Alkali-Metallen her und untersuchten den Flüssigkeitsstrahl mit weichem Röntgenlicht. Äußerlich zeigt sich der Übergang von einzelnen Metall-Atomen in Lösung zu einem metallischen Verbund, indem die Farbe der Lösung von blau zu golden wechselt. Diesen Vorgang konnten sie nun durch die Messdaten an BESSY II im Detail analysieren. Die Arbeit ist in Science publiziert und erscheint sogar als Titelgeschichte.
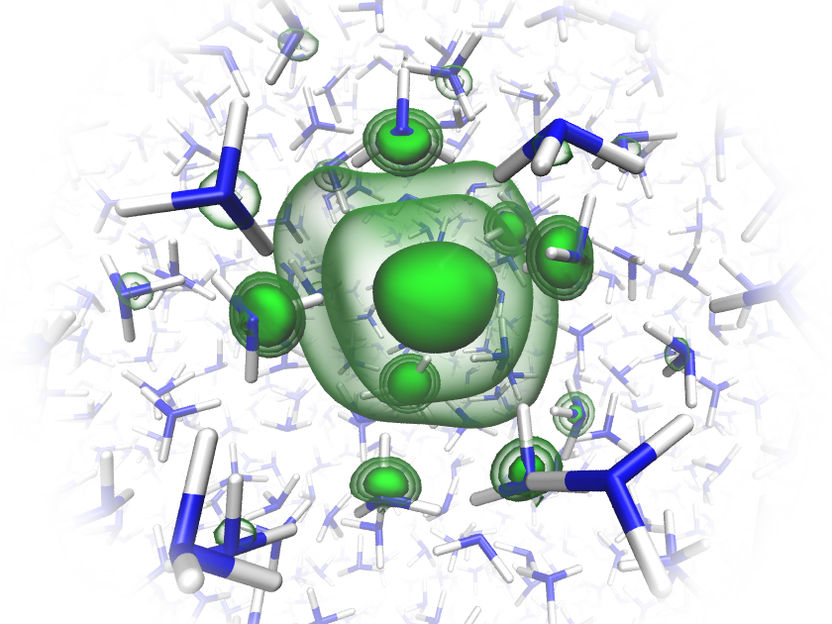
Die Theoretiker im Team haben die Struktur des solvatisierten Elektrons im flüssigen Ammoniak aufwendig simuliert.
© Charles Universität Prag/O. Maršálek & T. Martinek

Bei niedriger Konzentration der solvatisierten Elektronen ist die Ammoniaklösung blau.
© HZB

Was Metalle auszeichnet, ist allgemein bekannt. In einem Metall bewegt sich ein Teil der äußeren Elektronen in einem sogenannten Leitungsband durch das kristalline Gitter. Daher leiten Metalle elektrischen Strom.
Im Gegensatz zu Metallen sind in Elektrolyten die Ionen ungeordnet und die Leitfähigkeit nimmt sogar mit steigender Konzentration ab. Wie entsteht daher aus vielen einzelnen, gelösten Metall-Atomen im Elektrolyten ein metallisches Verhalten? Wie genau und bei welcher Konzentration bildet sich ein Leitungsband aus und wie verhalten sich die Orbitale dabei?
Nun hat eine große internationale Kooperation ein raffiniertes Experiment entwickelt, mit dem man diese Vorgänge erstmals beobachten konnte. Beteiligt waren 17 Autoren von renommierten Instituten, die über die ganze Welt verteilt sind: von Los Angeles, über Prag, Paris und Kyoto bis Berlin.
Einer der Hauptautoren ist Dr. Bernd Winter vom Fritz-Haber-Institut Berlin, der mit dem HZB-Nachwuchsgruppenleiter Dr. Robert Seidel und dessen Team die Versuchsanordnung am BESSY II aufgebaut hat. Im ersten Schritt stellten die Physiker Lösungen von Alkali-Metallen wie Lithium und Natrium in Ammoniak her. Dabei bilden sich positiv geladene Metall-Ionen und Elektronen gehen in Lösung. Diese Lösungen sind bei niedrigen Konzentrationen schwach blau, bei steigender Konzentration intensiviert sich die blaue Farbe bis sie dann plötzlich zu einem goldenen Farbton umschlägt. Dieser beeindruckende Farbwechsel hängt mit den Zuständen der gelösten Metall-Elektronen zusammen, vermuteten die Wissenschaftler.
An der SOL³PES-Maschine, die Robert Seidel an der Beamline U49/2-PGM-1 betreut, konnten sie sogenannte Mikrojets (einen sehr feinen flüssigen Strahl) aus den Ammoniak-Lösungen mit unterschiedlichen Alkali-Konzentrationen im Ultrahochvakuum mittels Photoelektronen-Spektroskopie untersuchen. Dabei mussten die Lösungen auf etwa minus 60 Grad Celsius gekühlt werden. Bei dieser Temperatur ist Ammoniak flüssig und die Verdampfung hinreichend gering. Tatsächlich konnten sie so den Übergang vom Elektrolyten zum Metall genau vermessen.
„Wir konnten zum ersten Mal das Photoelektronen-Signal der überschüssigen Elektronen in flüssigem Ammoniak einfangen. Wir beobachten einen Peak bei etwa 2 Elektronenvolt (eV), der das Vorhandensein von gelösten Elektronen und Di-Elektronen anzeigt“, sagt Winter. Und Seidel erläutert: „Das erklärt auch, warum die Lösung bei niedrigen und mittleren Metall-Konzentrationen zunächst blau ist: Die Lösung absorbiert Licht im roten Bereich, was dem Peak von 2 eV entspricht.“ Dadurch erscheint die Lösung schwach blau, solange es nur einzelne gelöste Elektronen gibt. Diese blaue Farbe intensiviert sich noch mit dem Erscheinen von ersten „Zweierpaaren“, den Di-Elektronen. Mit zunehmender Alkalimetall-Konzentration wechselt die Farbe ins Goldene. Gleichzeitig verbreitert sich der Peak zu einem Band mit der für Metalle charakteristischen, scharfen Fermi-Kante im Spektrum sowie mit Signalen, die charakteristisch für kollektive Anregungen (Plasmonen) freier Elektronen sind.
„Wir konnten die Messdaten so eindeutig interpretieren, weil unsere Kooperationspartner aus Prag, die Gruppen um die Theoretiker Pavel Jungwirth und Ondrej Marsalek, die elektronische Struktur von solvatisierten Elektronen in Lösung vorab modellieren konnten“, sagt Winter. Die berechneten Bindungsenergien passen sehr gut zu den experimentell ermittelten Werten.
Die Arbeit wird in Science publiziert, weil sie einen wichtigen Beitrag zum grundlegenden Verständnis des Übergangs von nicht-leitendem zu metallischem Charakter in Elektrolyten leistet. Dieses Verständnis ist auch für praktische Anwendungen hilfreich, so spielen solvatisierte, also gelöste Elektronen, z. B. in der organischen Chemie als Reduktionsmittel für aromatische Systeme eine Rolle, aber auch in Batterie-Elektrolyten und Kondensatoren.































































