Ungewöhnliche Verbindung macht Hoffnung auf neue Katalysatoren
Forscher synthetisieren ein Material, das unter anderem die Herstellung von Kraftstoffen vereinfachen könnte
Festkörperchemiker der Universität Augsburg haben ein neuartiges Material synthetisiert, das ungewöhnliche Eigenschaften aufweist. Möglicherweise ebnet es den Weg zu neuen Katalysatoren für Reaktionen, die bislang nur unter hohem Energieeinsatz möglich sind, etwa zur Produktion von Düngemitteln oder zur einfachen Herstellung von Methanol. An der Studie waren auch Arbeitsgruppen der Universitäten Freiburg und Regensburg beteiligt.
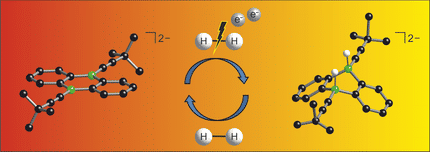
Das Lewis‐Säure‐Base‐Addukt von Wasser an das Borosulfat-Anion bereichert die Borosulfatchemie grundlegend und eröffnet neue Einblicke und Perspektiven für diese faszinierende silikatanaloge Materialklasse.
Universität Augsburg, CC BY-NC-ND
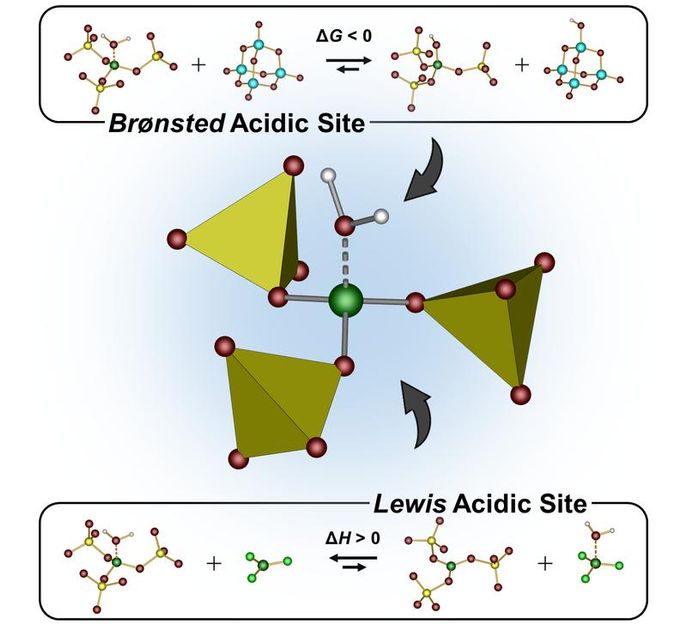
Die neuartige Festkörperverbindung stammt aus der Substanzklasse der Borosulfate. Bei ihnen geht ein Bor-Atom Bindungen zu mehreren Sulfatgruppen ein, die ihrerseits aus Schwefel und Sauerstoff bestehen. Typischerweise entsteht dabei eine Tetraeder-Struktur: Das Bor-Atom sitzt im Zentrum, vier Sulfatgruppen bilden die Tetraeder-Ecken. „Wir haben nun ein Borosulfat hergestellt, bei dem das Bor nur an drei Sulfatgruppen gebunden ist“, erklärt Prof. Dr. Henning Höppe vom Lehrstuhl für Festkörperchemie der Universität Augsburg. „An Stelle der vierten Gruppe entsteht dann eine Art Tasche, an die andere Moleküle andocken können.“
Atome bestehen aus einem positiv geladenen Kern, der von einer Hülle aus negativ geladenen Elektronen umgeben ist. Die Sulfatgruppen wirken nun auf die Elektronen des Bor-Atoms wie drei Staubsauger und ziehen sie ein Stück weit zu sich herüber. Das Bor ist daher bemüht, dieses Defizit auszugleichen - es lechzt gewissermaßen nach Elektronen.
Chemiker nennen solche Substanzen auch „Lewis-Säuren“. Ihnen ist gemeinsam, dass sie gerne Verbindungen zu Molekülen eingehen, die ihnen Elektronen spenden können - den Lewis-Basen. Bei dem neuartigen Borosulfat liegt in der freien Bindungstasche ein Wassermolekül, das diese Rolle übernimmt. „Vermutlich können aber auch Gase wie Kohlenmonoxid oder gar Stickstoff als Lewis-Base fungieren“, erläutert Philip Netzsch, der gerade seine Promotion in der Arbeitsgruppe von Prof. Höppe mit „Summa cum Laude“ abgeschlossen hat.
Wenn eine Lewis-Base an eine Lewis-Säure andockt, werden ihre Elektronen teilweise zur Säure hin verlagert. Dadurch werden die Bindungen innerhalb der Base geschwächt. „Kohlenmonoxid etwa besteht aus einem Kohlenstoff- und einem Sauerstoff-Atom, die durch eine sehr stabile Dreifachbindung miteinander verknüpft sind“, sagt Höppe. „Diese aufzubrechen, erfordert normalerweise viel Energie. Wenn das Molekül zunächst an unser Borosulfat bindet, destabilisiert das die Dreifachbindung, so dass sie sich deutlich leichter trennen lassen sollte.“
Auf diese Weise ließe sich Kohlenmonoxid möglicherweise in einem sehr effizienten Prozess zu Methanol umsetzen. Auch die umweltfreundliche Herstellung von Düngemitteln aus Luftstickstoff ist denkbar - ein Ziel, an dem sich Chemiker weltweit schon lange die Zähne ausbeißen. Das Borosulfat würde bei diesen Reaktionen nicht verbraucht werden, sondern lediglich als Katalysator dienen. Ob die Substanz hält, was sie verspricht, muss sie aber noch in weiteren Untersuchungen zeigen.
Lange Zeit wusste man nicht, ob sich Borosulfate überhaupt herstellen lassen. Dazu muss man nämlich zwei Säuren miteinander reagieren lassen - die schwache Borsäure mit der sehr starken Schwefelsäure. So ganz ohne Weiteres klappt das nicht. Seit den frühen 1960er Jahren gab es erste Hinweise auf erfolgreiche Synthesen, die Arbeitsgruppe um Prof. Höppe war aber 2012 die erste, der eine Strukturaufklärung einer solchen Verbindung gelang. „In den letzten Jahren haben wir die chemischen Prozesse bei der Synthese zunehmend besser verstanden“, erklärt er. „Dass es uns nun gelungen ist, diesen Vertreter einer völlig neuen Gruppe von Borosulfaten herzustellen, erweitert das Potential dieser Materialklasse enorm.“
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Chemie-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte

Electroquímica West, S.A. - La Estrella, Kolumbien

Arbeitgeberverband Chemie Baden-Württemberg e.V. - Baden-Baden, Deutschland
GDMB Gesellschaft der Metallurgen und Bergleute e. V. - Clausthal-Zellerfeld, Deutschland

Innovatives Pulver revolutioniert 3D-Metalldruck - Spin-Off will Forschungsergebnisse wirtschaftlich umsetzen

Schadstoffmessung aus der Ferne

Digitales Labormanagement: Vollumfänglich vernetzt - Eppendorf arbeitet mit eLabNext und Clustermarket zusammen

Base Europe GmbH - Hainspitz, Deutschland

Química Lavoisier, S.A. de C.V. - Guadalajara, Mexiko
Degussa baut Isophoron-Chemie in Nordrhein-Westfalen aus

Beilstein-Institut zur Förderung der Chemischen Wissenschaften - Frankfurt am Main, Deutschland