Neue PET-Hydrolase in menschlicher Spucke entdeckt
Enzym aus Speichelmikroben zersetzt PET-Kunststoffe
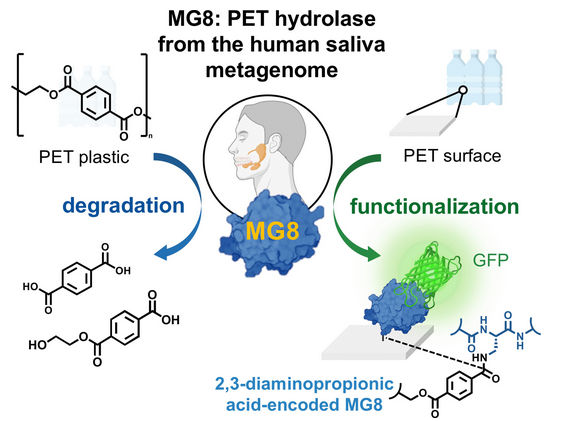
Menschlicher Speichel könnte ein Enzym enthalten, das den Kunststoff Polyethylenterephthalat (PET) zersetzen kann. Entdeckt hatten Forschende das Enzym in einer Datenbank für mikrobielle Genome, unter anderem aus menschlichem Speichel. Wie sie in der Zeitschrift Angewandte Chemie berichten, zerlegt diese neue Hydrolase PET aktiver in kleinere Moleküle als andere bekannte bakterielle Hydrolasen. Das Enzym lässt sich biotechnologisch produzieren und könnte für das Recycling oder die Funktionalisierung von Kunststoffmaterialien angepasst werden, schreiben die Autor:innen.
© Wiley-VCH
Mülldeponien und Hafenbecken gelten als besonders vielversprechende Orte, um Bakterien zu finden, die sich auf die Verwertung von Kunststoffen angepasst haben. Solche Bakterien haben Enzyme – PET-Hydrolasen genannt – entwickelt, die PET in kleinere Moleküle zerlegen können. Forschende um Chayasith Uttamapinant vom Vidyasirimedhi Institute of Science and Technology (VISTEC) in Rayong und Worawan Bhanthumnavin von der Chulalongkorn University in Bangkok (beide Thailand) haben nun das erste PET-abbauende Enzym aus einer eher ungewöhnlichen Quelle entdeckt: dem Mikrobengenom im menschlichen Speichel.
Da die Menschen viele Nahrungsmittel konsumieren, die aus PET-Verpackungen stammen, könnten sich die Mikroben im Speichel oder Darm auf die Einfuhr von Mikroplastik angepasst haben, vermuteten die Forschenden. Sie entdeckten die neue Hydrolase, die sie MG8 nannten, beim Durchkämmen einer öffentlichen Datenbank, die neben Proben aus Meerwasser auch solche aus menschlichem Speichel umfasste, und ordneten sie Gram-negativen Bakterien zu, die sich im menschlichen Speichel ansiedeln können. Diese Bakterien sind solchen Stämmen ähnlich, die nahe der riesigen Plastikstrudel in den Ozeanen gefunden wurden und die ebenfalls PET-Hydrolasen entwickelt hatten.
Um genügend Material für die Untersuchungen zu gewinnen, ließen sie das Enzym von einem im Labor kultivierbaren Bakterium produzieren. Aus einer denaturierten, also nicht korrekt gefalteten Form, die aber in großen Mengen isolierbar war, gewannen sie mit Leichtigkeit eine aktive Form des Enzyms, die PET zersetzen konnte. Das seien gute Voraussetzungen für eine Kultivierung im großtechnischen Maßstab, setzen die Autor:innen den Blick in die Zukunft.
Noch eine weitere Verwendung von MG8 haben die Forschenden im Visier. Sie entdeckten, dass MG8 nicht nur PET zerlegen kann, sondern es mit einer Modifikation auch sehr gut bindet. Dafür tauschten sie in der Proteinsequenz im aktiven Zentrum des Enzyms die Aminosäure Serin mit einer unnatürlichen Aminosäure aus. Das modifizierte Enzym heftete sich sofort an PET-Pulver an. Damit könnte es genutzt werden, um PET-Oberflächen zum Beispiel für die Medizintechnik oder ein effektiveres Recycling zu funktionalisieren.
Enzyme, die PET in kleine Moleküle zersetzen, könnten für das Plastikrecycling eingesetzt werden. Allerdings müsste dafür MG8, ebenso wie andere PET-Hydrolasen auch, weiter optimiert werden. Bislang können die PET-Hydrolasen das hochkristalline PET, wie es in Getränkebehältern verwendet wird, nicht zersetzen. Bis sich also eine ganze Wasserflasche in einer einfachen enzymhaltigen Waschlösung auflösen kann, sind weitere Forschungen nötig.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Bhumrapee Eiamthong et al.; Discovery and Genetic Code Expansion of a Polyethylene Terephthalate (PET) Hydrolase from the Human Saliva Metagenome for the Degradation and Bio-Functionalization of PET; Angewandte Chemie International Edition; 2022
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Chemie-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Riesiges Gas-Leck stinkt Bewohnern in Nobelviertel von Los Angeles - Wie groß ist die Gesundheitsgefahr tatsächlich?

M&A in Chemie und Life Sciences durch weltweite Lockdowns ausgebremst - Rennen um COVID-19 Impfstoff

Bruker BioSpin Corp. - Billerica, USA
Boehringer Ingelheim warnt vor Verkürzung des Patentschutzes

Messer Cutting & Welding GmbH - Frankfurt am Main, Deutschland
Enzyme eröffnen neue Wege in der Chemie - BASF intensiviert Arbeiten im Bereich Weiße Biotechnologie