Käfig mit Deckeln: Selektiver Einschluss von Seltenerdmetall-Hydraten in Wirtsmoleküle
Seltenerdmetall-Ionen selektiv gewinnen oder recyclen
Metalle der Seltenen Erden sind unabdingbar für viele technische Produkte, von Smartphones, Notebooks über Akkus, Elektromotoren und Windräder bis zu Katalysatoren. Ein japanisches Team stellt in der Zeitschrift Angewandte Chemie einen molekularen „Käfig“ mit „Deckeln“ vor, mit sich bestimmte Seltenerdmetall-Ionen selektiv gewinnen oder recyclen lassen.
© Wiley-VCH
Zu den Seltenen Erden zählen 17 Metalle: Scandium, Yttrium, Lanthan und die Lanthanoide, d.h. die 14 Elemente, die im Periodensystem auf Lanthan folgen, wie Neodym und Europium. Der Name ist irreführend, denn die Seltenerdmetalle sind nicht wirklich selten. Sie kommen in der Umwelt überall vor, aber fein verteilt und in Mineralien („Erden“) gebunden, große Lagerstätten sind selten. Die Rückgewinnung aus Elektroschrott gewinnt an Bedeutung. Inzwischen wurden Mikroorganismen entdeckt, die Enzyme mit Seltenerdmetallen enthalten. Sie könnten bei der (Rück-)Gewinnung helfen und liefern Anregungen für die Verwendung der Seltenerdmetalle als Katalysatoren.
Auch in Gewässern und Abwässern finden sich Ionen der Seltenerdmetalle. Aus wässrigen Lösungen können sie jedoch nur schwer einzeln abgetrennt werden, u.a. weil sie üblicherweise hydratisiert vorliegen, d.h. Wassermoleküle fest gebunden haben. Ihre Hydratationszustände unterscheiden sich und können variabel sein. Dies erschwert und stört die Erkennung und Isolierung der Ionen durch Bindung an Liganden.
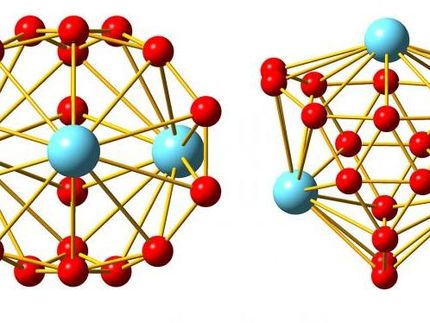
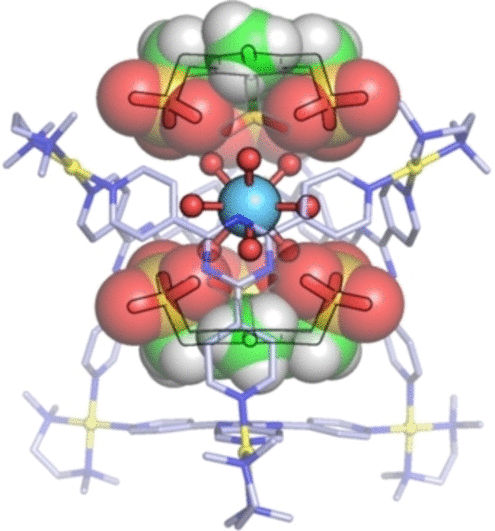
Dem Team um Makoto Fujita von der Universität Tokio und dem Institute for Molecular Science ist es jetzt gelungen, dreiwertige Ionen einer Reihe von Seltenerdmetallen in hydratisierter Form in geschlossenen „Käfigen“ einzufangen. Ein Käfigmolekül bestehen aus vier organischen Liganden in der Form dreieckiger „Platten“, deren Spitzen über sechs Palladium-Ionen miteinander zu einem oktaederförmigen Käfig mit zwei großen Öffnungen verknüpft sind. Das Seltenerdmetall-Ion findet mitsamt seinen neun gebundenen Wassermolekülen Platz im Käfig. Der entscheidende Kniff sind zwei „Deckel“, die die Öffnungen des Käfigs verschließen. Es handelt sich um planare Moleküle mit drei negativ geladenen Bindungsarmen, die über Wasserstoffbrücken an die Wassermoleküle der Seltenerdmetall-Ionen binden. Zusätzlich werden sie über elektrostatische Wechselwirkungen von den positiv geladenen Palladium-Ionen des Käfigs festgehalten.
Nicht alle Seltenerdmetall-Ionen werden gleich gut eingefangen. So bestimmen kleine Unterschiede der Radien und bevorzugten Hydratationsmodi, wie gut diese in die Käfige passen: Lanthan und die leichten Lanthanoide, wie Europium, werden wesentlich stärker gebunden als die schweren Lanthanoide, wie Ytterbium. Scandium z.B., das nur sechs Wassermoleküle koordiniert, kann sich im Käfig nicht stabil arrangieren und wird kaum gebunden.
Das Einschließen hydrophiler Metall-Spezies in einen abgeschlossenen Hohlraum könnte ein Ansatz zur Isolation von Seltenerdmetallen sein, aber auch für die Entwicklung neuartiger Katalysatoren, in Analogie zu metallhaltigen Enzymen (Metallozymen) von Mikroorganismen.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Chemie-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.