Universaldetektor aus DNA-Bausteinen
Mit Aptameren lassen sich vielfältige Stoffe quantitativ nachweisen und genau untersuchen
Eine Methode zur Detektion von so unterschiedlichen Stoffen wie Antibiotika, Betäubungsmittel oder Sprengstoff, also gleichsam einen Universaldetektor, haben Forscher des Max Planck-Instituts für Polymerforschung in Mainz entwickelt. Sein Kernstück ist ein so genanntes Rasterkraftmikroskop, mit dessen Hilfe einzelne Moleküle einem Zugtest unterzogen werden können. Die Mainzer Forscher ziehen damit an so genannten Aptameren, die etwa aus den Bausteinen der Erbsubstanz DNA aufgebaut sind. Bindet der gesuchte Stoff an die Aptamere ändert sich die Kraft, bei der sie auseinanderreißen. Auf diese Weise lässt sich der Stoff nicht nur in kleinen Konzentrationen zielgenau nachweisen, sondern auch genauer studieren. So lässt sich etwa untersuchen, wie die gesuchten Stoffe an Aptamere binden oder wie groß deren Bindungsstärke ist.
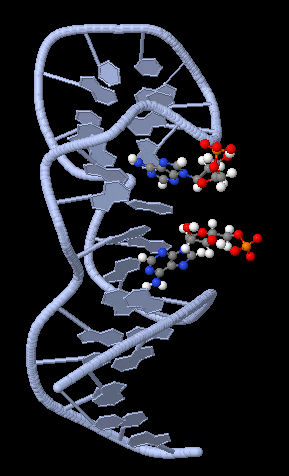
Vielseitig und doch selektiv: Unter einer großen Vielfalt von Aptameren finden sich die richtigen Detektoren für zahllose Stoffe. Die Analyt-Moleküle, hier AMP, binden an dafür geeignete Stellen. Dadurch verändert sich die Kraft, mit der sich Bindungen zwischen den beiden Hälften des Aptamers lösen lassen.
© R. Berger/MPI für Polymerforschung
Aptamere sind ein geradezu ideales Mittel, um Chemikalien höchst unterschiedlicher Art nachzuweisen. Sie bestehen typischer Weise aus den Bausteinen aus der die Erbsubstanz DNA und RNA und vereinen Universalität mit Spezifität. Sie bilden gewissermaßen einen Koffer voller Köder, mit denen sich jeweils eine andere Fischart fangen lässt. Ihre Vielseitigkeit resultiert aus den unzähligen Möglichkeiten, die Abfolge der vier Basen zu variieren, aus denen sich DNA zusammensetzt. Ihre Spezifität wiederum ergibt sich aus der räumlichen Struktur, die ein DNA-Strang mit einer bestimmten Basen-Abfolge annimmt. Dadurch ergeben sich im Aptamer individuell geformte Taschen, in die nur bestimmte Moleküle hineinpassen, wie eine Tonfigur in ihre Form. „Für die meisten Moleküle, seien es Antibiotika, Kokain, TNT oder Proteine, lassen sich Aptamere mit passenden Taschen finden“, sagt Rüdiger Berger vom Max-Planck-Institut für Polymerforschung.
Aus den passenden Aptameren suchen die Mainzer Forscher eines heraus, welches sich so in zwei Teile schneiden lässt, dass das in der Tasche gebundene Zielmolekül eine Brücke zwischen den beiden Hälften bildet. Ein solches Aptamer dürfte sich meist in der Vorauswahl finden, sagt Mark Helm vom Institut für Pharmazie der Johannes Gutenberg-Universität Mainz, Mitautor der Studie. Für ihre ersten Versuche mit dem Universaldetektor haben die Forscher als Zielmolekül Adenosinmonophosphat (AMP) und ein Aptamer gewählt, das Taschen für zwei AMP-Moleküle besitzt.
Dann verankern sie die eine Hälfte des geteilten Aptamers an der Spitze eines Rasterkraftmikroskopes und die andere auf einer Unterlage. Wenn sie nun die Spitze senken und die Hälften in Kontakt kommen, bilden sich so genannte Wasserstoffbrücken-Bindungen zwischen einzelnen Basen der beiden Aptamer-Hälften. Wird die Spitze zurückgezogen, spannt sich das verbundene Aptamer wie eine Feder. Die dabei entstehende Kraft lässt sich messen. Sie steigt mit der Dehnung, bis die Hälften bei einer bestimmten Kraft auseinanderreißen. In einem zweiten Versuch haben die Forscher dem System vor dem Auseinanderziehen eine Lösung des Biomoleküls Adenosinmonophosphat (AMP) hinzugefügt. Dadurch setzen sich zwei AMP-Moleküle in die freien Taschen. Alle zwei bilden dabei Wassserstoffbrückenbindungen mit beiden Aptamer-Hälften aus. Durch diese Brückenfunktion verstärken die AMP-Moleküle den Zusammenhalt der beiden Teile. Sie reißen daher erst bei einer deutlich größeren Kraft ab. Durch diesen Unterschied lässt sich das AMP detektieren.
Mögliche Anwendungen in Umweltanalytik und medizinischer Diagnostik
Für die Ermittlung der Reißkräfte haben die Forscher die Messungen 1000 Mal wiederholt und einen statistischen Mittelwert bestimmt. Er lag für das AMP-beladene Aptamer bei rund 39 Pikonewton, rund 12 Pikonewton höher als ohne das AMP. Als Kontrolle haben sie ein mutiertes Aptamer mit anders geformter Bindungstasche verwendet, bei dem die Reißkraft sich nicht veränderte. Auch lässt sich durch die Zweiteilung des Aptamers elegant die Bindungsstärke zwischen dem AMP und den Aptamer bestimmen. Dazu wurde schrittweise die Konzentration der AMP Moleküle in der Lösung erhöht, bis etwa die Hälfte aller Zugversuche eine Erhöhung der Zerreiskraft zeigte. Je größer die dafür nötige Konzentration ist, desto kleiner ist die Bindungsstärke.
Die neue Methode eigne sich nicht nur zur Detektion von bestimmten Molekülen in einer Lösung, sondern auch zur Erforschung einzelner Moleküle, sagt Berger. „Man kann zum Beispiel mit einer definierten Kraft an dem Aptamer ziehen, ohne es zu zerreißen und untersuchen, wie sich die Eigenschaften der Molekül-Aptamer-Verbindung verändert“, sagt Berger. Man könnte auch das Zielmolekül verändern, sodass es z.B. statt drei nur zwei Wasserstoffbrückenbindungen mit der Tasche ausbildet. „Dadurch ist es möglich zu verstehen, welche Bindungen von Zielmolekül und Aptamer von Bedeutung sind“, erklärt Berger.
Das Wissen um Aptamere und ihre Bindungseigenschaften hat großes Anwendungspotenzial. Die DNA-Stücke werden schon heute für Umweltanalytik und in der medizinischen Diagnostik eingesetzt. Ihre Einsatzgebiete als molekulare Werkzeuge und Bausteine könne sich dank neuer Erkenntnisse mit der neuen Methode noch erweitern, sagt Berger.


































































