Neuer, hocheffizienter Katalysator für die Propylenherstellung
Innovativer Katalysator für die Synthese von Propylen bietet potenzielle Vorteile für die chemische Industrie und das Kohlenstoffrecycling
Propylen ist ein farbloses, entflammbares Kohlenwasserstoffgas, das ein wichtiger Rohstoff für die Herstellung einer Vielzahl von Petrochemikalien ist. Aufgrund der steigenden Nachfrage und des begrenzten weltweiten Angebots besteht ein großer Bedarf an der Entwicklung neuer, effizienter Technologien für seine Herstellung.
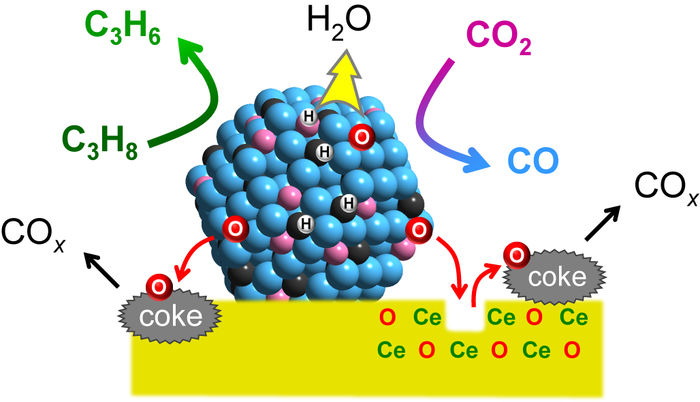
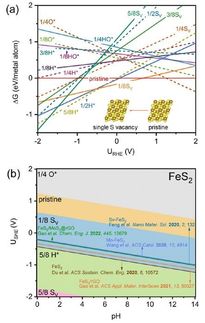
Mechanismus der katalytischen Wirkung. Platin wandelt Propan (C3H8) in Propylen (C3H6) um, während Kobalt CO2 einfängt und aktiviert. In Kombination mit Indium und fixiert auf einem Ceroxidträger (CeO) ist die Bildung von Propylen mit der Desoxygenierung von CO2 verbunden und spezifisch für Propan. Als Nebenprodukte entstehen Wasser (H2O) und Kohlenstoffoxide (COx).
Shinya Furukawa

(Links) Der Platin-Kobalt-Indium-Katalysator in Pulverform; (Rechts) eine elektronenmikroskopische Aufnahme des Katalysators (Struktur im oberen Bildteil) auf einem Träger aus Ceroxid (CeO2, Struktur im unteren Bildteil).
Shinya Furukawa

Forscher der Universität Hokkaido haben einen innovativen Katalysator für die Herstellung von Propylen entwickelt, der hochaktiv, selektiv und stabil ist und Kohlendioxid (CO2) effizient nutzt. Ihre Ergebnisse wurden in der Zeitschrift Nature Catalysis veröffentlicht.
Eine vielversprechende Technik zur Herstellung von Propylen ist eine chemische Reaktion, die so genannte oxidative Dehydrierung, bei der CO2 verwendet wird, um Propangas durch Entfernung von Wasserstoff in Propylen umzuwandeln. Die vorhandenen Katalysatoren, die zur Beschleunigung dieser chemischen Reaktion eingesetzt werden, sind jedoch nicht sehr effizient.
"Die Herausforderung besteht darin, einen Katalysator zu entwickeln, der beide Reaktanten - Propan undCO2 - ohne unerwünschte Nebenreaktionen aktivieren kann. Außerdem muss er langfristig stabil und wiederverwendbar sein", erklärt der Molekularingenieur Shinya Furukawa von der Universität Hokkaido.
Um dies zu erreichen, entwickelten Furukawa und seine Kollegen einen Katalysator aus drei verschiedenen Metallen (Platin, Kobalt und Indium), die jeweils aufgrund ihrer spezifischen Eigenschaften ausgewählt wurden. Platin wurde aufgrund seiner Fähigkeit, chemische Bindungen zwischen Kohlenstoff und Wasserstoff aufzubrechen und so die Dehydrierungsreaktion zu ermöglichen, als das wichtigste aktive Metall ausgewählt. Kobalt beschleunigt die CO2-Abscheidung und -Aktivierung, während Indium die Selektivität des Katalysators erhöht. Die Metalle wurden auf einem Träger aus Ceriumoxid fixiert, einer Verbindung, die häufig in Autokatalysatoren verwendet wird.
Die Forscher testeten die Aktivität des Katalysators bei 550 °C und verglichen die Ergebnisse mit bestehenden Katalysatoren. Sie führten auch eine mechanistische Studie durch, um die Funktionen der verschiedenen Komponenten zu verstehen, und stellten fest, dass der Katalysator die Propylenbildungsreaktion mit der Desoxygenierung von CO2 verbindet und sicherstellt, dass die katalytische Aktivität spezifisch für Propan ist; als Nebenprodukte entstehen Wasser und Kohlenoxide. Außerdem stellten sie fest, dass der Katalysator die Reaktionsgeschwindigkeit im Vergleich zu den typischen Werten anderer Systeme um das Fünffache erhöht. Bei der Reaktion wurde ein höherer Anteil an Propylen erzeugt und bei 550 °C mehr CO2 verbraucht als bei früheren Katalysatoren. Der Katalysator zeigte auch eine gute Langzeitstabilität und Wiederverwendbarkeit.
"Bislang ist kein anderer Katalysator bekannt, der gleichzeitig eine hohe katalytische Aktivität, Selektivität, Stabilität und CO2-Nutzungseffizienz aufweist. Unser multifunktionales Material erfüllt alle diese Anforderungen", sagt Furukawa.
Diese Studie bietet neue Einblicke in die Entwicklung hocheffizienter Katalysatoren für die petrochemische Produktion und hat potenzielle Vorteile für das Kohlenstoffrecycling und die Reduzierung von Treibhausgasen.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.